
分析 (1)强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热,依据题干条件结合化学方程式计算对应量的焓变,标注物质聚集状态写出热化学方程式;
(2)①N2H4(l)+2 H2O2(l)=N2(g)+4 H2O(g)△H=-641.63 kJ/mol
②H2O(l)=H2O(g);△H=+44kJ/mol
依据盖斯定律①-②×4得到:N2H4(l)+2 H2O2(l)=N2(g)+4 H2O(l)△H=-817.63kJ/mol,依据热化学方程式可知32g肼反应放热817.63KJ,则8g液态肼与液态双氧水反应生成液态水时放出的热量是204.4KJ;
(3))①N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol
依据盖斯定律计算②×2-①得到:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l).
解答 解:(1)0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652kJ的热量,1mol液态肼和过氧化氢反应放热641.63 KJ;反应的热化学方程式为:
N2H4(l)+2 H2O2(l)=N2(g)+4 H2O(g)△H=-641.63 kJ/mol
故答案为:N2H4(l)+2 H2O2(l)=N2(g)+4 H2O(g)△H=-641.63 kJ/mol
(2)①N2H4(l)+2 H2O2(l)=N2(g)+4 H2O(g)△H=-641.63 kJ/mol
②H2O(l)=H2O(g);△H=+44kJ/mol
依据盖斯定律①-②×4得到:N2H4(l)+2 H2O2(l)=N2(g)+4 H2O(l)△H=-817.63kJ/mol,依据热化学方程式可知32g肼反应放热817.63KJ,则8g液态肼与液态双氧水反应生成液态水时放出的热量是204.4KJ;
故答案为:204.4;
(3)①N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol
依据盖斯定律计算②×2-①得到:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l),△H=-1135.7 kJ/mol;
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)△H=-1135.7 kJ/mol.
点评 本题考查了热化学方程式的书写方法和盖斯定律的计算应用,标注物质聚集状态,计算反应焓变是解题关键,题目较简单.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:解答题
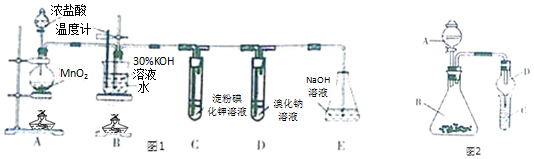
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 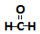 + +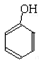 → →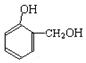 属于取代反应 属于取代反应 | |
| B. | 可以用酸性高锰酸钾溶液鉴别苯和己烷 | |
| C. | 有机物C3H8和C6H14一定是同系物 | |
| D. | 丙烯分子中可能有8个原子处于同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
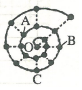 小明在研究元素时发现,可以将前18号元素排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
小明在研究元素时发现,可以将前18号元素排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 虚线相连的元素处于同一族,A元素位于元素周期表ⅥA族 | |
| B. | 离O点越远的元素原子半径一定越大 | |
| C. | B、C最高价氧化物的水化物可以相互反应 | |
| D. | B元素是图中金属性最强的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
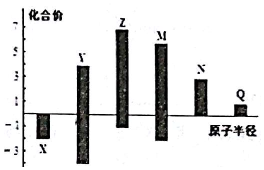
| A. | 金属性:N>Q | |
| B. | 最高价氧化物对应水化物酸性:M>Y>N | |
| C. | 简单离子半径:Q>N>X | |
| D. | 原子序数:Z>M>X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干燥剂硅胶和硅橡胶的主要化学成分都是二氧化硅 | |
| B. | 手机外壳上贴的碳纤维外膜是一种新型无机非金属材料 | |
| C. | 用淀粉溶液可以直接检验海水中是否含碘元素 | |
| D. | 明矾净水的原理和“84”消毒液消毒的原理相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com