
| A. | 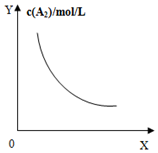 对于反应:A2(g)+3B2(g)?2AB2(g),图①中的横轴x可以表示压强 | |
| B. | 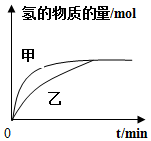 如图表示其他条件相同时,甲、乙两份等质量锌粉分别与足量稀硫酸反应,甲中加入少量铜粉 | |
| C. |  如图可表示乙酸溶液中通入氨气至过量时溶液导电性的变化 | |
| D. |  据图,若除去0.1mol•L-1CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH至pH约为7 |
分析 A、对于反应:A2(g)+3B2(g)?2AB2(g),增大压强,平衡正向移动;
B、构成原电池加快化学反应的速率;
C、乙酸溶液中通入氨气,首先生成强电解质乙酸铵,溶液的导电能力增强,再通入氨气离子浓度基本不变;
D、NaOH至pH约为7时铜离子也开始沉淀.
解答 解:A、对于反应:A2(g)+3B2(g)?2AB2(g),增大压强,平衡正向移动,所以A2的浓度变大,而不是减小,故A错误;
B、构成原电池加快化学反应的速率,锌粉中混有铜粉,构成原电池,反应速率加快,故B正确;
C、乙酸溶液中通入氨气,首先生成强电解质乙酸铵,溶液的导电能力增强,再通入氨气离子浓度基本不变,所以溶液的导电能力是先增强再基本保持不变,故C错误;
D、NaOH至pH约为7时铜离子也开始沉淀,所以不能加碱到pH=7,故D 错误;
故选B.
点评 本题考查化学平衡的图象,明确外界条件对化学平衡的影响及图象中纵横坐标的含义、“定一议二”“先拐先平”,同时要掌握电化学、电解质溶液的相关知识,即可解答,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | a=2 | |
| B. | x=18 | |
| C. | M的化学式为MgO | |
| D. | 该反应中Mg5Al3(OH)x(H2O)4既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
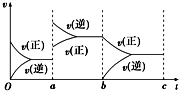 (1)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一.
(1)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一.| 实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
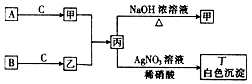 已知A、B、C为中学常见的气体单质,甲、乙、丙、丁为常见的化合物,甲的水溶液呈碱性.它们之间有如图所示的转化关系(部分产物及反应条件已略去)
已知A、B、C为中学常见的气体单质,甲、乙、丙、丁为常见的化合物,甲的水溶液呈碱性.它们之间有如图所示的转化关系(部分产物及反应条件已略去)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚氯乙烯的结构简式为: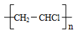 | B. | 乙醇的官能团的电子式为: | ||
| C. | S2-的结构示意图为: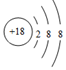 | D. | 乙酸的实验式为C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
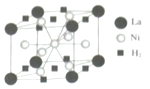 钒和镍及其化合物是重要的催化剂和合金材料.请回答:
钒和镍及其化合物是重要的催化剂和合金材料.请回答: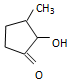 可形成配合物.
可形成配合物. 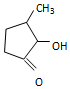 中,三种非金属原子的第一电离能由大到小的顺序为O>C>H(用元素符号表示);C原子的杂化轨道类型为sp3和sp2.
中,三种非金属原子的第一电离能由大到小的顺序为O>C>H(用元素符号表示);C原子的杂化轨道类型为sp3和sp2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用图所示装置除去乙烯中少量SO2气体 | |
| B. |  用图装置量取20.00 mL 0.10 mol•L-1硫酸 | |
| C. |  用图所示装置可分离CH3COOC2H5和饱和碳酸钠溶液 | |
| D. | 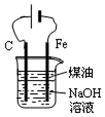 用图装置制备Fe(OH)2并能较长时间观察其颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
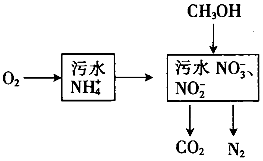 处理生活污水中的NH4+,过程如下:
处理生活污水中的NH4+,过程如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸 | |
| B. | 相同温度相同pH的CH3COONa、NaAlO2和NaHCO3三种溶液的物质的量浓度大小为:c(NaAlO2)<c(NaHCO3)<c(CH3COONa) | |
| C. | 0.1 mol/L的NaA溶液和0.1 mol/L的HA溶液等体积混合pH=4.75,则溶液:c (HA)+2c(H+)=2c(OH-)+c(A-) | |
| D. | 向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com