
| 酸 | 电离方程式 | 电离常数 K/mol•L-1 |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.26×10-5 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?CO32-+H+ | K1=4.31×10-7 K2=5.61×10-11 |
| H2S | H2S?H++HS- HS-?H++S2- | K1=9.1×10-8 K2=1.1×10-12 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
分析 (1)弱电解质电离是吸热反应,升高温度促进电离;
(2)同一温度下,酸的电离常数越大其酸性越强;
(3)同一温度下,酸的电离常数越大其酸性越强,根据酸的电离常数确定酸性强弱;
(4)同一多元弱酸的电离常数差别很大;产生相同离子时抑制其电离.
解答 解:(1)弱酸的电离是吸热反应,升高温度促进弱酸电离,所以电离平衡常数增大,故答案为:增大;
(2)同一温度下,酸的电离常数越大其电离程度越大,则酸性越强,故答案为:Ka值越大酸性越强;
(3)同一温度下,酸的电离常数越大其酸性越强,根据酸的电离常数知,酸性最强的是H3PO4,最弱的是HPO42-,故答案为:H3PO4;HPO42-;
(4)H3PO4的Ka1、Ka2、Ka3之间存在数量上的规律,即同一多元弱酸的电离常数差别很大;产生相同离子时抑制电解质的电离,多元弱酸电离时上一级电离产生的H+对下一级电离有抑制作用,所以其电离常数逐渐减小,
故答案为:在数值上相差很大;上一级电离产生的H+对下一级电离有抑制作用.
点评 本题考查弱电解质的电离,明确酸性强弱与电离程度、电离平衡常数的关系是解本题关键,难度不大,注意对表中数据的分析和应用.


科目:高中化学 来源: 题型:解答题
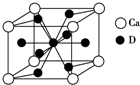 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
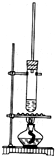 已知1-丁醇的沸点为117.7℃,乙酸的沸点为118℃,甲同学拟在浓硫酸作用下,使1-丁醇和乙酸进行酯化反应制乙酸丁酯(反应温度115~125℃)
已知1-丁醇的沸点为117.7℃,乙酸的沸点为118℃,甲同学拟在浓硫酸作用下,使1-丁醇和乙酸进行酯化反应制乙酸丁酯(反应温度115~125℃)查看答案和解析>>
科目:高中化学 来源: 题型:多选题
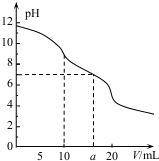 常温下,用 0.1mol•L HCl溶液滴定10.0mL浓度为0.1mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,用 0.1mol•L HCl溶液滴定10.0mL浓度为0.1mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )| A. | 当V=0时:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-) | |
| B. | 当V=5时:c(Na+ )>c(HCO3-)>c(CO32- )>c(Cl- ) | |
| C. | 当V=a时:c(Na +)>c(Cl- )>c(H+ )=c(OH- ) | |
| D. | 当V=10时:c(H+ )+c(H2CO3)=c(OH- )+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||
| 1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
| 2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| 3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
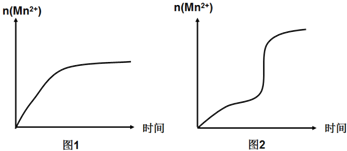
| 实验编号 | 室温下,试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
| 4 | 3.0 | 2.0 | 2.0 | 3.0 | MnSO4 | t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 12种 | C. | 15种 | D. | 20种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
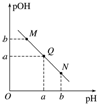
| A. | M点所示溶液的导电能力强于Q点 | |
| B. | N点所示溶液中c(CH3COO-)>c(Na+) | |
| C. | Q点水的电离程度在MN直线上最大 | |
| D. | Q点消耗NaOH溶液的体积小于醋酸溶液的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
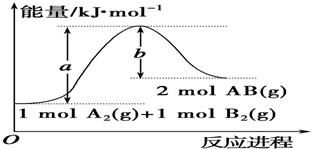
| A. | 每生成2分子AB吸收b kJ热量 | |
| B. | 该反应吸收热量 (a-b)kJ | |
| C. | 该反应中反应物的总能量低于生成物的总能量 | |
| D. | 断裂1mol A-A和1mol B-B键,放出a kJ能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com