
| A. | 氯气的性质活泼,它与氢气混合后立即发生爆炸 | |
| B. | 检验HCl气体中是否混有Cl2方法是将气体通入硝酸银溶液 | |
| C. | 浓HCl在与MnO2共热制取Cl2的实验中只起到还原剂的作用 | |
| D. | 实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钠溶液吸收 |
分析 A.氯气的性质活泼,它与氢气在光照的条件下发生爆炸;
B.氯化氢、氯气都和硝酸银溶液反应生成白色沉淀;
C.依据反应中氯元素化合价变化解答;
D.氯气和氢氧化钠反应.
解答 解:A.氯气和氢气在光照条件下产生爆炸,故A错误;
B.氯气和水反应生成盐酸和次氯酸,氯化氢和硝酸银反应生成氯化银沉淀,所以氯气、氯化氢都能和硝酸银溶液反应生成白色沉淀,所以硝酸银溶液不能用于检验HCl气体中是否混有Cl2,故B错误;
C.反应中氯化氢中一部分氯化合价升高表现还原性,另一部分的HCl中的氯化合价不变,起到酸性的作用,故C错误;
D.氯气和氢氧化钠反应生成氯化钠和次氯酸钠,可用氢氧化钠溶液吸收氯气,防止污染环境,故D正确;
故选:D.
点评 本题考查了物质的性质,熟悉氯气的性质是解题关键,注意氯水的成分和性质,题目难度不大.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:解答题
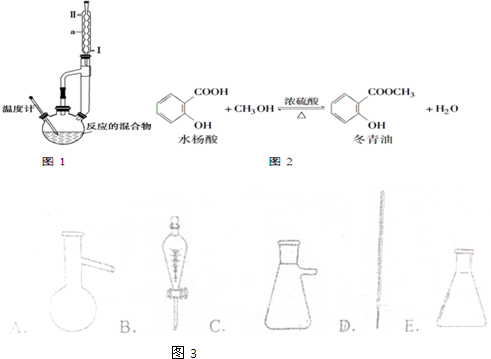
| 相对分 子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 冬青油 | 152 | 1.180 | 222.2 | 微溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变外界条件使化学平衡状态改变时,平衡常数也一定改变 | |
| B. | 改变条件,反应物的转化率增大,平衡常数一定增大 | |
| C. | 若一个可逆反应的平衡常数很大,则反应会在较短的时间内完成 | |
| D. | 已知2NO2?N2O4正反应的平衡常数为K1,逆反应的平衡常数为K2,则K1=$\frac{1}{{K}_{2}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 周期 | IA | ⅡA | ⅢA | IVA | VA | VIA | VⅡA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com