
分析 充分燃烧8.88g该有机物,浓硫酸增重10.8g为水的质量,碱石灰增重21.12g为生成二氧化碳,计算二氧化碳和水的物质的量,计算分子中C、H原子数目,再结合质量守恒判断氧原子及数目,据此确定化合物的最简式,有机物的蒸汽密度为3.3g/L,则相对分子质量为3.3×22.4=74.最后根据相对分子质量和最简式写出分子式.
解答 解:浓硫酸增重10.8g为水的质量,n(H2O)=$\frac{10.8g}{18g/mol}$=0.6mol,n(H)=2n(H2O)=1.2mol,m(H)=1.2mol×1g/mol=1.2g;
碱石灰增重21.12g为生成二氧化碳,则n(CO2)=$\frac{21.12g}{44g/mol}$=0.48mol,n(C)=n(CO2)=0.48mol,m(c)=0.48mol×12g/mol=5.76g,
m(H)+m(c)=1.2g+5.76g=6.96g<8.88g,所以含有氧原子,m(O)=8.88g-6.96g=1.92g,n(O)=$\frac{1.92g}{16g/mol}$=0.12mol,N(C):N(H):N(O)=0.48mol:1.2mol:0.12mol=4:10:1,故最简式为C4H10O,
有机物的蒸汽密度为3.3g/L,则相对分子质量为3.3×22.4=74,则分子式为C4H10O,
答:有机物的分子式为C4H10O.
点评 本题考查了有机物分子式的确定,为高频考点,题目难度中等,根据原子守恒计算确定有机物的分子式是关键,试题培养了学生灵活应用所学知识的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | C14H16O4 | B. | C14H18O5 | C. | C16H22O5 | D. | C16H20O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 化学反应中能量变化的主要原因是物质状态的改变 | |
| B. | 铝与盐酸的反应中,反应物的总能量比生成物的总能量高 | |
| C. | 图I所示的装置能将化学能转变为电能 | |
| D. | 图II所示的反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红棕色的NO2加压后颜色先变深后变浅 | |
| B. | 由氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深 | |
| C. | 加入铁触媒做催化剂更有利于工业合成氨 | |
| D. | 锌粒粉碎后与稀硫酸反应产生氢气速度更快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素.请用化学用语回答下列问题:
短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素.请用化学用语回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
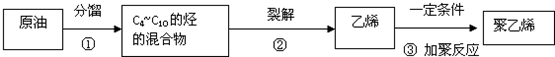
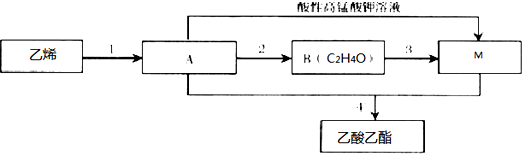
 ,
,
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验剩余的药品不能放回原试剂瓶 | |
| B. | 点燃可燃性气体前必须验纯 | |
| C. | 气体实验装置在实验前要进行气密性检查 | |
| D. | 滴管不能交叉使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
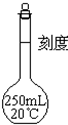 配制250mL 1mol/LNaOH溶液.回答下列问题:
配制250mL 1mol/LNaOH溶液.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com