
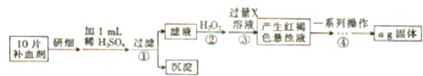
| A、原N2、H2混合气体为1.0V L |
| B、原N2、H2混合气体为1.2V L |
| C、参加反应的N2为0.1V L |
| D、原混合气体中N2、H2体积比为1:3 |
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 原子半径(nm) | 0.102 | 0.110 | 0.117 | 0.074 | 0.075 | 0.071 | 0.099 | 0.186 |
| 最高化合价 | +6 | +5 | +4 | +5 | +7 | +1 | ||
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、品红溶液 | B、石蕊溶液 |
| C、氯水 | D、碘化钾-淀粉溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | A | B | C | D |
| 装置 |  | 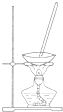 |  | 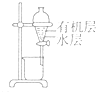 |
| 目的 | 除去Cl2中含有的少量HCl | 蒸干NH4Cl饱和溶液制备NH4Cl晶体 | 制取少量CO2气体 | 分离CCl4萃取碘水后已分层的有机层和水层 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换 |
| B、Na2O2中阴阳离子数数目之比为1:1 |
| C、Cl2与SO2均能使品红褪色,说明二者均有氧化性 |
| D、NO能够与人体里的血红蛋白结合,造成人体缺氧中毒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com