
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
分析 ①滴定时当最后一滴NaOH溶液加入时,溶液颜色恰好由无色变为浅红色,酚酞的变色范围是8.2~10;
②根据c(酸)×V(酸)=c(碱)×V(碱)计算;
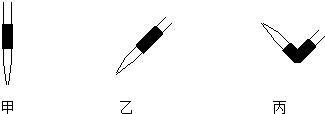
③碱式滴定管的气泡通常橡皮管内,只要将滴定玻璃头朝上,并挤橡皮管中的玻璃珠就可以将气泡冲排出.
解答 解:①滴定时最后一滴NaOH溶液加入时,溶液颜色恰好由无色变为(浅)红色,酚酞的变色范围是8.2~10,所以滴定终点是溶液PH为8.2~10;
故答案为:加入最后一滴氢氧化钠溶液,溶液由无色恰好变成浅红色,且半分钟内不褪色;8.2~10;
②根据c(酸)×V(酸)=c(碱)×V(碱),需要V(NaOH)=$\frac{22.62+22.72+22.80}{3}$mL=22.71mL,则该盐酸的浓度为$\frac{22.71×1{0}^{-3}L×0.10mol/L}{20.00×1{0}^{-3}L}$=0.1136mol/L,故答案为:0.1136mol/L;
③碱式滴定管的气泡通常橡皮管内,只要将滴定玻璃头朝上,并挤橡皮管中的玻璃珠就可以将气泡冲排出,故答案为:丙.
点评 本题考查中和滴定操作,为高频考点,侧重于学生的分析能力和实验能力的考查,题目难度中等,注意把握实验基本方法,能会分析导致误差的不当操作,注意把握实验操作要点和注意事项.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
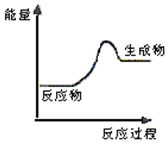
| A. | 该反应可能为吸热反应 | |
| B. | 该反应一定有能量转化成了生成物的化学能 | |
| C. | 反应物比生成物稳定 | |
| D. | 生成物的总能量高于反应物的总能量,反应不需要加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3COOCH2CH3+H2O,反应类型是酯化反应.
CH3COOCH2CH3+H2O,反应类型是酯化反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n(CO2)/mol | 0 | 1 | 3 | 1 |
| n(H2)/mol | 0 | 2 | 2 | 1 |
| n(CO)/mol | 3 | 0.5 | 1 | 2 |
| n(H2O)/mol | 3 | 2 | 5 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 银盐 性质 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| 溶解度(mol•L-1) | 1.34×10-6 | 7.1×10-7 | 1.1×10-8 | 6.5×10-5 | 1.0×10-6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com