
【题目】已知A是来自石油的重要有机化工原料,E是具果香味的有机物,F是一种高聚物,可制成多种包装材料。
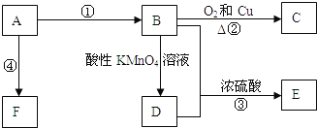
(1)A的电子式为:____________,C的名称:_____________,E的名称:____________ F的结构简式:________________。
(2)D分子中的官能团名称是____________,请设计一种实验来验证D物质存在该官能团的方法是_________________________________________。
(3)写出下列反应的化学方程式并指出反应类型:___________,反应类型_____________。
【答案】![]() 乙醛 乙酸乙酯
乙醛 乙酸乙酯 ![]() 羧基 向D中滴几滴紫色石蕊溶液,若溶液变红,则证明D中存在羧基 CH3COOH+CH3CH2OH
羧基 向D中滴几滴紫色石蕊溶液,若溶液变红,则证明D中存在羧基 CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O 酯化反应(取代反应)
CH3COOCH2CH3+H2O 酯化反应(取代反应)
【解析】
A是来自石油的重要有机化工原料,A得到的F是一种高聚物,可制成多种包装材料,则A为CH2=CH2,CH2=CH2发生加聚反应生成高聚物F为![]() ;B能与O2在Cu存在下发生反应生成C,B能与酸性KMnO4溶液发生反应,则A与H2O发生加成反应生成的B是CH3CH2OH,B发生催化氧化生成的C为CH3CHO,B被酸性高锰酸钾溶液氧化生成的D是乙酸CH3COOH,CH3COOH与CH3CH2OH发生酯化反应生成的E为CH3COOCH2CH3,据此解答。
;B能与O2在Cu存在下发生反应生成C,B能与酸性KMnO4溶液发生反应,则A与H2O发生加成反应生成的B是CH3CH2OH,B发生催化氧化生成的C为CH3CHO,B被酸性高锰酸钾溶液氧化生成的D是乙酸CH3COOH,CH3COOH与CH3CH2OH发生酯化反应生成的E为CH3COOCH2CH3,据此解答。
由上述分析可知A为CH2=CH2,B为CH3CH2OH,C为为CH3CHO;D为乙酸CH3COOH,E为CH3COOCH2CH3。
(1)由上述分析可知,A是乙烯,乙烯分子中两个C原子形成2对共用电子对,每个C原子与2个H原子形成2对共用电子对,其电子式为![]() ;C为CH3CHO,其名称为乙醛;E是CH3COOCH2CH3,E的名称是乙酸乙酯;F的结构简式为
;C为CH3CHO,其名称为乙醛;E是CH3COOCH2CH3,E的名称是乙酸乙酯;F的结构简式为![]() ;
;
(2)D是乙酸,分子含有的官能团是羧基-COOH,检验羧基的方法是:取少量D物质于试管中,向其中滴加几滴紫色的石蕊试液,若溶液变为红色,说明该物质含有-COOH;
(3)反应③是乙醇与乙酸发生酯化反应生成乙酸乙酯和H2O,反应方程式为:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,该反应类型为酯化反应,也属于取代反应。
CH3COOCH2CH3+H2O,该反应类型为酯化反应,也属于取代反应。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(1)用系统命名法命名: ![]() ____________________________________。
____________________________________。
(2)2,6-二甲基-4-乙基辛烷的结构简式是_______________________,1 mol该烃完全燃烧需消耗氧气____mol。
(3)在烃的分子结构中,若每减少2个氢原子,则相当于碳碳间增加1对共用电子。试完成下列问题:
①分子式为CnH2n+2的烃分子中碳碳间共用电子对数为______。
②碳碳间共用电子对数为n的单烯烃的分子式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是
A.硫化氢溶于水:H2S![]() 2H++S2-
2H++S2-
B.熔融状态下的NaHSO4:NaHSO4=Na++H++SO42-
C.碳酸氢钠溶于水:NaHCO3=HCO3-+Na+
D.醋酸溶于水:CH3COOH=CH3COO-+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】698 K时,向某V L的密闭容器中充入2 mol H2(g)和2 mol I2(g),发生反应:H2(g)+I2(g)2HI(g) ΔH=-26.5 kJ·mol-1,测得各物质的物质的量浓度与时间的变化关系如图所示。
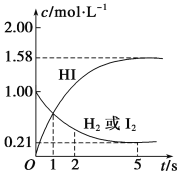
该反应达到平衡状态时,______(填“吸收”或“放出”)的热量为:____kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不反应的是( )
①C6H5Cl ②(CH3)2CHCH2Cl ③(CH3)3CCH2Cl ④CHCl2-CHBr2 ⑤![]() ⑥CH2Cl2
⑥CH2Cl2
A. ①③⑥B. ②③⑤C. ②④D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。
(1)该反应的平衡常数表达式K=______;根据图,升高温度,K值将______(填“增大”“减小”或“不变”)。

(2)500℃时,从反应开始达到化学平衡,以H2的浓度变化表示的化学反应速率是______(用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是_________(填字母,下同)。
a.v生成(CH3OH)=v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度之比为1:2:1
(4)300℃时,将容器的容积压缩到原来的![]() ,在其他条件不变的情况下,对平衡体系产生的影响是______(填字母)。
,在其他条件不变的情况下,对平衡体系产生的影响是______(填字母)。
a.c(H2)减小
b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加
d.重新平衡时![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列数据:
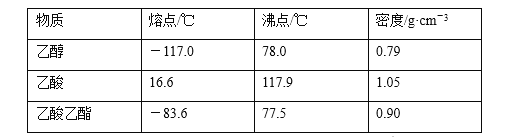
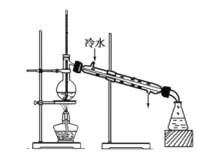
某学生在实验室制取乙酸乙酯的主要步骤如下:
①配制2 mL浓硫酸、3 mL乙醇和2 mL乙酸的混合溶液。
②按图连接好装置(装置气密性良好)并加入混合液,用小火均匀加热3~5 min。
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。
④分离出乙酸乙酯,洗涤、干燥、蒸馏。最后得到纯净的乙酸乙酯。
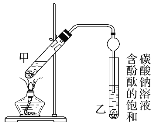
(1)反应中浓硫酸的作用是_________。
(2)写出制取乙酸乙酯的化学方程式:_________。
(3)上述实验中饱和碳酸钠溶液的作用是________。
(4)步骤②为防止加热过程中液体爆沸,该采取什么措施__________。
(5)欲将乙试管中的物质分离以得到乙酸乙酯,必须使用玻璃的仪器有____;分离时,乙酸乙酯应从仪器_____(填“下口放”或“上口倒”)出。
(6)通过分离后饱和碳酸钠中有一定量的乙醇,拟用图回收乙醇,回收过程中应控制温度是_____;找出图中的错误_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】易混易错题组:按题目要求填写下列空白。
(1) 用价层电子对互斥模型预测下列微粒的立体结构,并指出后两种物质中中心原子的杂化方式。
H2Se______________ CF4_______________SO2______________ 、______SO42-______________、_______
(学法题)简述价层电子对互斥模型与分子的立体结构之间的关系_________________________
(2)写出下列物质的系统命名:
①(CH3)3COH________________②CH3CHClCOOH ___________________
③![]() ________________ ④
________________ ④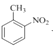 ________________
________________
(3)下列原子核外电子排布中,违背“泡利不相容原理”的是_________;违背“洪特规则”的是_______;违背“洪特 规则特例”的是___________。违背“能量最低原理”的是________;(填编号)
① 6 C轨道表示为![]()
②7N轨道表示为:![]()
③29 Cu电子排布式为:1s 2 2s 2 2p 6 3s 2 3p 6 3d 9 4s 2
④20 Ca电子排布式为:1s 2 2s 2 2p 6 3s 2 3p 6 3d 2
⑤O: ![]()
(学法题)在解答此题时必须明确概念,简述泡利原理,洪特规则的概念:___________________________
(4)按要求书写化学方程式
①CH3CH(OH)CH3的催化氧化:__________________________________________
②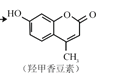 和氢氧化钠溶液反应____________________________________________
和氢氧化钠溶液反应____________________________________________
③过量乙酸与甘油的酯化反应_________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在分液漏斗中用一种有机溶剂提取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。答:____________________________。
(2)下列操作会使配制的KOH溶液的物质的量浓度偏大的是_______
A、转移溶液后未洗涤烧杯和玻璃棒就直接定容
B、转移溶液过程中有液体溅出容量瓶
C、定容时俯视刻度线
D、配制溶液定容摇匀后发现容量瓶中液面低于刻度线,又补足了水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com