
分析 0.1mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6mol,根据原子守恒可知,该烃的分子式为C6H12,该烃能使溴水褪色,说明分子中含有1个C=C键,该烃属于烯烃,在催化剂作用下与H2加成生成2.2-二甲基丁烷( ),相邻两个碳原子都含有H原子为C=C双键位置,确定该烃的结构简式,以此解答该题.
),相邻两个碳原子都含有H原子为C=C双键位置,确定该烃的结构简式,以此解答该题.
解答 解:0.1mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6mol,根据原子守恒可知,该烃的分子中N(C)=$\frac{0.6mol}{0.1mol}$=6,N(H)=$\frac{0.6mol×2}{0.1mol}$=12,故该烃的分子式为C6H12,
该烃能使溴水褪色,说明分子中含有1个C=C键,该烃属于烯烃,在催化剂作用下与H2加成生成2,2-二甲基丁烷( ),相邻两个碳原子都含有H原子为C=C双键位置,该烃的结构简式为:(CH3)3CCH=CH2,名称为3,3-二甲基-1-丁烯,与溴水反应的方程式为:(CH3)3CCH=CH2+Br2→(CH3)3CCHBrCH2Br,
),相邻两个碳原子都含有H原子为C=C双键位置,该烃的结构简式为:(CH3)3CCH=CH2,名称为3,3-二甲基-1-丁烯,与溴水反应的方程式为:(CH3)3CCH=CH2+Br2→(CH3)3CCHBrCH2Br,
故答案为:C6H12;(CH3)3CCH=CH2;3,3-二甲基-1-丁烯;(CH3)3CCH=CH2+Br2→(CH3)3CCHBrCH2Br.
点评 本题考查有机物分子式确定、限制条件同分异构体书写、有机物的命名、烯烃的性质等,难度不大,侧重对基础知识的巩固,注意掌握燃烧法利用原子守恒确定有机物分子式.


科目:高中化学 来源: 题型:选择题
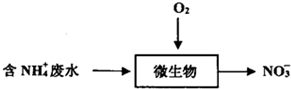
| A. | 生物硝化法处理废水,会导致水体pH逐渐下降:NH4++202=NO3-+2H++H20 | |
| B. | 长期过量使用NH4Cl等铵态化肥,易导致土壤酸化,水体富营养化 | |
| C. | 检验NH4+所需的试剂是浓NaOH溶液,湿润的蓝色石蕊试纸 | |
| D. | 微生物保持活性的pH范围为7〜9,可以加入石灰石来调节水体的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
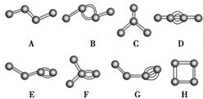 如图表示4个碳原子相互结合的方式.小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合.
如图表示4个碳原子相互结合的方式.小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
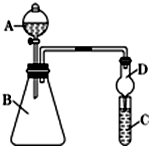 小明和同班同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
小明和同班同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热金属铝使之熔化 | B. | 液态SO3受热蒸发 | ||
| C. | 加热HI气体使之分解 | D. | 加热石英晶体使之熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为了充分应用资源,用工业废碱液(Ca(OH)2、NaOH)与烟道气(回收成份SO2)来制取石膏(CaSO4•2H2O)和过二硫酸钠(Na2S2O8).设计简要流程如下:
为了充分应用资源,用工业废碱液(Ca(OH)2、NaOH)与烟道气(回收成份SO2)来制取石膏(CaSO4•2H2O)和过二硫酸钠(Na2S2O8).设计简要流程如下: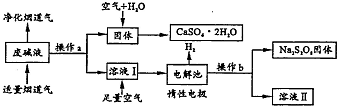
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
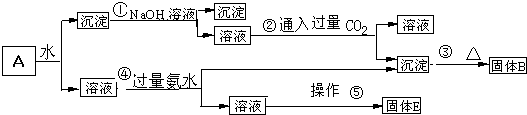
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
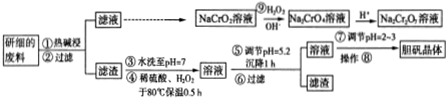
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
| pH | 2.9 | 6.7 | 9.4 | 9.7 |
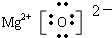 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时NaTi2(PO4)3在正极发生还原反应 | |
| B. | 充电过程中阳极反应式为:2NaNiFeⅢ(CN)6+2Na++2e-=2Na2NiFeⅡ (CN)6 | |
| C. | 放电时负极材料中的Na+脱离电极进入溶液,同时溶液中的Na+嵌入到正极材料中 | |
| D. | 该电池在较长时间的使用过程中电解质溶液中Na+的浓度基本保持不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com