
 已知某温度下,在2L密闭容器中加入一定量A,发生以下化学反应:
已知某温度下,在2L密闭容器中加入一定量A,发生以下化学反应:| A、该温度下此反应平衡常数为3.2 | ||
| B、A的初始物质的量为4 mol | ||
| C、0-15min内,气体密度不变 | ||
D、要使
|
| c(B) |
| c(A) |
| c(B)c(C) |
| c2(A) |
| c(B) |
| c(A) |
| c(B) |
| c(A) |
| c(B)c(C) |
| c2(A) |
| 1.6×1.6 |
| 0.82 |
| c(B) |
| c(A) |


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| A、Na2O和Na2O2的混合物共1mol,阴离子数目为NA |
| B、过量的Fe与Cl2反应生成0.1mol产物时失去的电子数为0.2NA |
| C、标准状况下,11.2 L CHCl3中含有C-Cl键的数目为1.5NA |
| D、一定条件下,2mol H2和0.5mol N2充分反应后可得到NH3分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
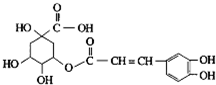 金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )
金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )| A、绿原酸的分子式为C16H8O9 |
| B、1mol绿原酸最多与4mol NaOH反应 |
| C、1个绿原酸分子中含有4个手性碳原子 |
| D、绿原酸分子中有4种化学环境不同的氢原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、恒容密闭容器中进行反应:2A2(g)+B2(g)?2A2B(g);△H<0,达到化学平衡后,加热会使逆反应速率大于正反应速率 |
| B、在常温下,用惰性电极电解饱和Na2CO3溶液,Na2CO3溶液的浓度不变 |
| C、使用催化剂能够改变反应历程,增大反应物分子的接触面积,从而加快反应速率 |
| D、放热或熵增过程自发进行的可能性比吸热或熵减过程要大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 用铂丝蘸取某待测液在酒精灯外焰上灼烧 | 火焰呈黄色 | 待测液不含钾元素 |
| B | AgBr沉淀中滴入KCl溶液 | 有白色沉淀出现 | AgCl比AgBr更难溶 |
| C | 铁丝插入稀硝酸中 | 有无色气体产生 | 生成氢气 |
| D | 向NaCN溶液中滴加无色酚酞试液 | 溶液变红 | HCN是弱电解质 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
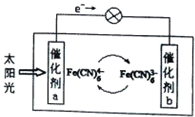 一种太阳能电池的工作原理示意图如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )
一种太阳能电池的工作原理示意图如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )| A、K+移向催化剂b |
| B、催化剂a表面发生反应:Fe(CN)64--e-═Fe(CN)63- |
| C、Fe(CN)63-在催化剂b表面被氧化 |
| D、电解质溶液中Fe(CN)63-和Fe(CN)64-浓度基本保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PM2.5是指大气中直径≤2.5微米的颗粒物,只要戴普通口罩就对人体健康无影响 |
| B、乙醇、过氧化氢、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的 |
| C、绚丽缤纷的烟花中可能添加了含钾、钠、钙、铜等某些金属元素的化合物 |
| D、制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蛋白质及其水解产物都具有两性 |
| B、淀粉和油脂都是可水解的高分子化合物 |
| C、鸡蛋清溶液中加入饱和Na2SO4溶液有沉淀生成是因为蛋白质变性 |
| D、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com