
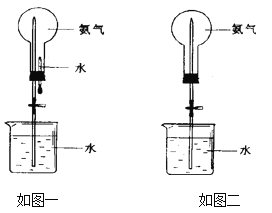
【题目】喷泉是一种常见的自然现象,其产生的原因是存在压强差。制取氨气并完成喷泉实验(图中夹持装置均已略去)。
①写出实验室制取氨气的化学方程式:______________。
②收集氨气应使用_________法,要得到干燥的氨气可选用_________做干燥剂。
③用如图一装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是___________,该实验的原理是____________________。
④如果只提供如图二的装置,请说明引发喷泉的方法__________________________。
【答案】2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O 向下排空气 碱石灰 打开止水夹,挤出胶头滴管中的水 氨气极易溶解于水,致使烧瓶内气体压强迅速减小 打开夹子,用手(或热毛巾等)将烧瓶捂热,氨气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉
CaCl2+2NH3↑+2H2O 向下排空气 碱石灰 打开止水夹,挤出胶头滴管中的水 氨气极易溶解于水,致使烧瓶内气体压强迅速减小 打开夹子,用手(或热毛巾等)将烧瓶捂热,氨气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉
【解析】
①在实验室中是用加热氯化铵和碱固体混合物的方法制取氨气;
②根据氨气密度和溶解性判断收集方法;根据氨水显碱性判断使用的干燥剂;
③喷泉实验利用的原理是产生压强差;
④设法使烧瓶内的氨气从导气管内逸出,与烧杯内的水接触就可以形成喷泉。
①实验室用加热氯化铵和消石灰固体混合物的方法制取氨气,反应的方程式为2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
②由于氨气的密度比空气小,极易溶于水,因此可用向下排气法收集;氨气是碱性气体,能与酸性物质发生反应,也能够与中性干燥剂氯化钙结合生成络合物,因此氨气只能选择碱性干燥剂如碱石灰、CaO等进行干燥;
③氨气是一种极易溶于水的气体,在上部烧瓶已装满干燥氨气,若要引发水上喷,由于外界大气压强不变,因此只能通过减小上部气体压强的方法,具体操作是将胶头滴管中的水挤入烧瓶中,瓶内氨气在水中溶解,使烧瓶内的气体压强减小,在外界大气压的作用下,水被压到瓶内,形成喷泉现象;该实验的原理实质上就是利用氨气极容易溶于水,致使烧瓶内气体压强迅速减小,烧瓶内外形成足够的压强差,烧杯内的水在大气压强作用下不断进入烧瓶,形成喷泉;
④如图二中无吸有水的胶头滴管,若要引发喷泉实验,使水进入烧瓶,可打开止水夹,用手(或热毛巾等)将烧瓶捂热,烧瓶内的氨气受热膨胀,玻璃导管内的空气赶出,氨气与水接触,使导气管内的气体压强减少,烧杯内的水在外界大气压强作用下进入烧瓶,即发生喷泉。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】以废旧电路板为原料制备硫酸铜可以变废为宝。下图是某科研小组设计的工艺流程(流程中 RH 为萃取剂),下列说法不正确的是

A.“粉碎”可以增大反应的接触面积,提高浸取速率和铜的浸取率
B.“浸取”发生的离子反应为 Cu+H2O2+2NH3 +2NH4+=Cu(NH3)42++2H2O
C.工艺流程中循环使用的物质有 NH3、NH4Cl、RH 和有机溶剂
D.从硫酸铜溶液获得纯净的硫酸铜晶体的操作是:加入适量乙醇,蒸发浓缩、冷却结晶、过滤、热水洗涤、干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
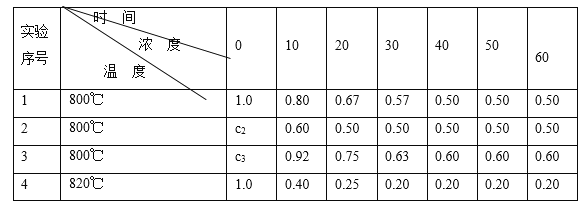
【题目】某化学反应2A ![]() B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为_____mol/(L·min)。
(2)在实验2,A的初始浓度c2=____________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是___________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3_______v1(填>、=、<),且c3_______1.0 mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是____反应(选填吸热、放热)。理由是 __________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知A的结构简式为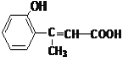 写出A中所有的官能团名称____________
写出A中所有的官能团名称____________
(2)异丙苯![]() 是一种重要的有机化工原料。根据题意完成下列填空:
是一种重要的有机化工原料。根据题意完成下列填空:
①由异丙苯制备对溴异丙苯的反应试剂和反应条件为______________________________ 。
② α-甲基苯乙烯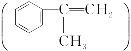 工业上由异丙苯催化脱氢得到。也可由异丙苯通过另一种方法制得,写出用另一种方法制得α-甲基苯乙烯的有关化学反应方程式:_____________________________________________________________________
工业上由异丙苯催化脱氢得到。也可由异丙苯通过另一种方法制得,写出用另一种方法制得α-甲基苯乙烯的有关化学反应方程式:_____________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如图所示,
其中反应条件及部分产物均已略去,则下列有关说法正确的是
A.X使蔗糖变黑的现象主要体现了X的强氧化性
B.若A为铁,则足量A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水中,最后有白色沉淀产生
D.工业上,B转化为D的反应条件为加热、使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,N2O分解的部分实验数据如下( )
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O)/molL-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
下图能正确表示该反应有关物理量变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
A.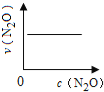 B.
B.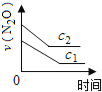 C.
C.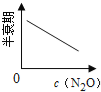 D.
D.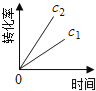
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组取部分变质的Ca(OH)2(含杂质CaCO3)样品4.0g投入200.0g水中,充分搅拌,通入足量CO2,溶液质量与反应的CO2质量的关系如图所示.则:
(1)以Ca(OH)2全部转化为CaCO3时消耗的CO2质量为_____g;
(2)4.0g样品中杂质CaCO3的质量为______________?(写出计算过程)
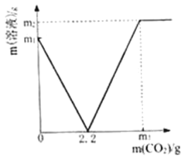
(3)通入m3gCO2时,溶液中生成物的溶质的质量分数为_____(精确到0.1%).若所取样品中的Ca(OH)2没有完全溶于水,对最后的计算结果_____(填“有”、“没有”)影响.原因是_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应![]() 在容积为10L的密闭容器中进行。起始时
在容积为10L的密闭容器中进行。起始时![]() 和
和![]() 均为0.20mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法不正确的是( )
均为0.20mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法不正确的是( )
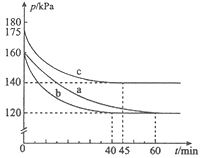
A. 实验c条件下,从反应开始至达到平衡时![]()
B. 实验a条件下,用浓度表示的平衡常数为100
C. 该反应的![]()
D. 比较实验a、c可判断升高温度反应速率加快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com