
(4分)工业上常用天然气作为制备甲醇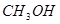 的原料。已知:
的原料。已知:
①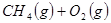
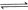
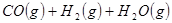
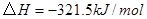
②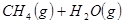
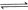
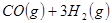
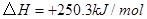
③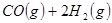
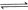
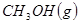
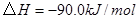
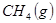 与
与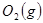 反应生成
反应生成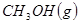 的热化学方程式为 。
的热化学方程式为 。
(2)向VL恒容密闭容器中充入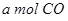 与
与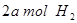 ,在不同压强下合成甲醇。
,在不同压强下合成甲醇。 的平衡转化率与温度、压强的关系如下图所示:
的平衡转化率与温度、压强的关系如下图所示: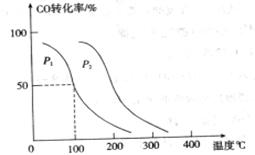
①压强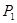
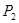 (填“<”、“>”或“=”)
(填“<”、“>”或“=”)
②在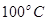 、
、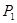 压强时,平衡常数为 (用含
压强时,平衡常数为 (用含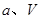 的代数式表示)。
的代数式表示)。
(1)2CH4(g)+O2(g)=2CH3OH (g) ΔH=-251.2KJ/mol(2)① < ; ②V2/a2;
解析试题分析:(1)①+②+③×2整理可得2CH4(g)+O2(g)=2CH3OH (g) ΔH=-251.2KJ/mol。(2)① 作一条等温线,通过P1、P2,可见在相同的温度下,压强是P2时CO 的平衡转化率高,由于该反应的正反应是气体体积减小的反应,根据压强对平衡移动的影响,增大压强,平衡正向移动,物质的转化率提高,所以压强P1< P2. ②在100℃、P1压强时,由于CO的转化率是50%,则平衡时CO的物质的量浓度是0.5a/Vmol/L; H2的物质的量浓度是a/Vmol/L; CH3OH的物质的量浓度是0.5a/Vmol/L;所以平衡常数为0.5a/V÷[0.5a/V×(a/V)2]= V2/a2。
考点:考查盖斯定律的应用、热化学方程式的书写、压强对化学平衡移动的影响、化学平衡常数的计算。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:单选题
化学家认为石油、煤作为能源使用时,燃烧了“未来的原始材料”。下列对上述观点理解正确的是
| A.大力提倡使用廉价化石燃料作为能源 |
| B.应更多地利用石油和煤生产基本化工原料 |
| C.化石燃料属于可再生能源,不影响可持续发展 |
| D.研发新型催化剂,提高石油和煤中各组分的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
碘与氢气反应的热化学方程式是
①I2(g) + H2(g)  2HI(g) ΔH =-9.48 kJ·mol-1
2HI(g) ΔH =-9.48 kJ·mol-1
②I2(s) + H2(g)  2HI(g) ΔH =" +26.48" kJ·mol-1
2HI(g) ΔH =" +26.48" kJ·mol-1
下列说法正确的是( )
| A.①的产物比②的产物稳定 |
| B.I2(s) = I2(g) ΔH=" +17.00" kJ·mol-1 |
| C.②的反应物总能量比①的反应物总能量低 |
| D.1mol I2(g)中通入1 mol H2(g),发生反应时放热9.48 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(4分,每空1分)如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入几小片镁片,再用滴管滴5mL稀盐酸于试管中。
试回答下列问题:
(1)实验中观察到的现象是 。
(2)产生上述现象的原因是 。
(3)写出有关反应的离子方程式: 。
(4)由实验推知, 溶液和氢气的总能量 (填“大于”“小于”或“等于”)镁片和稀盐酸的总能量。
溶液和氢气的总能量 (填“大于”“小于”或“等于”)镁片和稀盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
①CO(g)+H2O(g)  CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)工业上可用煤制天然气,生产过程中有多种途径生成CH4。
(1)写出CO2与H2反应生成CH4和H2O的热化学方程式 。
已知: ① CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
② C(s)+2H2(g) CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
③ 2CO(g) C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
(2)另一生成CH4的途径是CO(g)+3H2(g) CH4(g)+H2O(g)。其他条件相同时,H2的平衡转化率在不同压强下随温度的变化如图所示。
CH4(g)+H2O(g)。其他条件相同时,H2的平衡转化率在不同压强下随温度的变化如图所示。
①该反应的△H 0(填“<”、“=”或“>”)。
②实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由________________________。
③某温度下,将0.1 mol CO和0.3 mol H2充入10L的密闭容器内发生反应CO(g)+3H2(g)  CH4(g)+H2O(g),平衡时H2的转化率为80%,求此温度下该反应的平衡常数K。(写出计算过程,计算结果保留两位有效数字)
CH4(g)+H2O(g),平衡时H2的转化率为80%,求此温度下该反应的平衡常数K。(写出计算过程,计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(共12分)(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出257.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
①反应的热化学方程式为 。
②又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g) △H=—24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=—47.4kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 反应过程的能量变化如图所示。已知l mol SO2(g)氧化为1 molSO3 (g)的
反应过程的能量变化如图所示。已知l mol SO2(g)氧化为1 molSO3 (g)的 。请回答下问题;
。请回答下问题;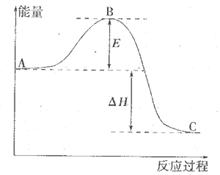
(1)E表示___________________;E的大小对该反应的反应热__________(填“有”或“无”)影响。
(2)该反应通常用V2O5作催化剂,加V2O5会使图中△H___________(填“变大”、“变小”或“不变”),理由是________。
(3)已知单质硫的燃烧热为296 kJ·mol ,计算由S(s)生成2mol SO3(g)的△H =________________。
,计算由S(s)生成2mol SO3(g)的△H =________________。
(4)在一定条件下向容积为2L的容器中通入4molSO2和3molO2,充分反应达平衡后,SO3的体积分数为1/3。若在相同的条件下向容积为2L的容器中通入amolSO2和,bmolSO3,和cmol,反应向逆反应方向进行且达到平衡时SO3的体积分数也为1/3。则c的取值范围为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)(Ⅰ)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇。
已知某些化学键的键能数据如下表:
| 化学键 | C—C | C—H | H—H | C—O | C≡O | H—O |
| 键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com