
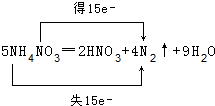
分析 (1)5NH4NO3═2HNO3+4N2↑+9H2O中,铵根离子中N元素化合价由-3价升高为氮气中的0价,共失去15个电子,被还原的氮元素由硝酸根中+5价降低为氮气中的0价,共获得15个电子;
(2)反应中只有氮元素化合价变化,发生氧化反应的氮原子化合价由-3价升高为0价,发生还原反应的氮原子由+5价降低为0价,根据电子转移守恒计算;
(3)根据5NH4NO3═2HNO3+4N2↑+9H2O计算;
解答 解:(1)5NH4NO3═2HNO3+4N2↑+9H2O中,铵根离子中N元素化合价由-3价升高为氮气中的0价,共失去15个电子,被还原的氮元素由硝酸根中+5价降低为氮气中的0价,共获得15个电子,用双线桥表示该反应电子转移的方向和数目为: ,故答案为:
,故答案为: ;
;
(2)反应中只有氮元素化合价变化,发生氧化反应的即被氧化的N元素化合价由-3价升高为0价,发生还原反应的即被还原的氮元素由+5价降低为0价,根据电子转移守恒,被氧化与被还原的N原子个数之比为5:3,故答案为:5:3;
(3)由5NH4NO3═2HNO3+4N2↑+9H2O反应,则每生成1mol硝酸生成2molN2即在标准状况的体积为2×22.4=44.8L,故答案为:44.8.
点评 本题考查氧化还原反应、物质的量有关计算,难度不大,侧重对基础知识的巩固,注意掌握单线桥、双线桥表示电子转移.


科目:高中化学 来源: 题型:选择题
| A. | 加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定有硫酸根离子 | |
| B. | 用四氯化碳萃取某溶液时,分层且下层显紫红色,可能存在碘单质 | |
| C. | 加入AgNO3溶液,有白色沉淀生成,证明含有Cl- | |
| D. | 加入盐酸,放出能使澄清的石灰水变浑浊的无色无味的气体,证明一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.5 mol•L-1CuCl2溶液中含有Cu2+的个数为0.5NA | |
| B. | 7.8g过氧化钠含有的共用电子对数为0.2NA | |
| C. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.1NA | |
| D. | 1mol羟基中电子数为10 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ③④ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 A、B、C、D、E是中学常见的五种物质,其转化关系如图所示,反应I、Ⅱ均在水溶液中进行,其中某些物质可能已略去.其中D是单质.C、E是化合物.若B是淡黄色粉末,反应I的原理用于呼吸面具中提供氧气.写出A的电子式
A、B、C、D、E是中学常见的五种物质,其转化关系如图所示,反应I、Ⅱ均在水溶液中进行,其中某些物质可能已略去.其中D是单质.C、E是化合物.若B是淡黄色粉末,反应I的原理用于呼吸面具中提供氧气.写出A的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,实验设计和实验过程如下:
为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,实验设计和实验过程如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室.分别向A、B两室充入H2、O2的混合气体和1mo1空气.此时活塞的位置如图所示.
室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室.分别向A、B两室充入H2、O2的混合气体和1mo1空气.此时活塞的位置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | Fe3+ | Al3+ | ZrO2+ |
| 开始沉淀时pH | 1.9 | 3.3 | 6.2 |
| 完全沉淀时pH | 3.2 | 5.2 | 8.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com