
【题目】工业合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g),对其研究如下:
2NH3(g),对其研究如下:
(1)已知H—H键能为436kJ·mol-1,N—H键能为391kJ·mol-1,N≡N键的键能是946kJ·mol-1,则上述反应的ΔH=_________________。
(2)上述反应的平衡常数K的表达式为____________,若反应方程式改写为NH3(g)![]() N2(g)+
N2(g)+![]() H2(g),则平衡常数K1=____________________(用K表示)。
H2(g),则平衡常数K1=____________________(用K表示)。
(3)在773K时,分别将2mol N2和6mol H2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | m | 1.80 | 1.98 | 2.00 | 2.00 |
①表格中m=_______________/span>,15~25min内,v(N2)=_______________。
②该温度下,若向同容积的另一容器中投入的N2、H2、NH3浓度均为3mol·L-1,此时v正_______v逆(填“>”、“<”或“=”)。
③由表中的实验数据计算得到“浓度~时间”的关系可用图中的曲线表示,表示c(N2)~t的曲线是______________(填“甲”、“乙”或“丙”)。在此温度下,若起始充入4mol N2和12mol H2,反应刚达到平衡时,表示c(H2)的曲线上相应的点为_________________。

(4)Marnellos和Stoukides采用电解法合成氨,实现了常压合成和氮气的高转化率。该方法用SCY陶瓷将两极隔开,SCY陶瓷具有高质子导电性,其作用是传导H+,则阴极的电极反应为____________________。
【答案】-92kJ·mol-1 K=c2(NH3)/[c3(H2)![]() c(N2)] K-1/2 1.6mol 0.01mol/(L
c(N2)] K-1/2 1.6mol 0.01mol/(L![]() min) > 乙 B N2+6e-+6H+=2NH3或N2+6e-+8H+=2NH4+
min) > 乙 B N2+6e-+6H+=2NH3或N2+6e-+8H+=2NH4+
【解析】
(1)化学反应中,旧键断裂吸收能量,新键形成释放能量;
(2)K=c2(NH3)/[c3(H2)![]() c(N2)],K1=c1.5(H2)
c(N2)],K1=c1.5(H2)![]() c0.5(N2)/c(NH3)判断;
c0.5(N2)/c(NH3)判断;
(3)①根据表中数据,10min时,氢气反应2.4mol,则生成1.6mol的氨气;
②根据表化学平衡常数与Qc的关系判断;
③根据氮气的初始c(N2)=2mol/L判断;根据等效平衡及反应速率的影响判断反应的点;
(4)电解池中,阴极得电子,化合价降低,则氮气得电子与氢离子反应生成氨气。
(1)化学反应中,旧键断裂吸收能量,新键形成释放能量,则ΔH=946+436![]() 3-391
3-391![]() 6=-92kJ/mol;
6=-92kJ/mol;
(2)上述反应的平衡常数的表达式为K=c2(NH3)/[c3(H2)![]() c(N2)],K1=c1.5(H2)
c(N2)],K1=c1.5(H2)![]() c0.5(N2)/c(NH3)=K-1/2;
c0.5(N2)/c(NH3)=K-1/2;
(3)①根据表中数据,10min时,氢气反应2.4mol,则生成1.6mol的氨气;15~25min内,氢气反应0.3mol,则氮气反应0.1mol,v(N2)=0.1mol/1L/10min=0.01mol/(Lmin);
②根据表中数据,25min时达到平衡状态,各物质的物质的量浓度为1mol/L、3mol/L、2mol/L,K=4/9,若向同容积的另一容器中投入的N2、H2、NH3浓度均为3mol/L时,Qc=1/9<K,平衡正向移动,v正>v逆;
③氮气的初始c(N2)=2mol/L,反应过程中浓度减小,则曲线乙符合;在此温度下,若起始充入4mol N2和12mol H2,相当于增大压强,体积减小,平衡正向移动,但氢气的浓度增大,速率加快,到达平衡时间减少,则B点符合;
(4)电解池中,阴极得电子,化合价降低,则氮气得电子与氢离子反应生成氨气,电极反应式为N2+6e-+6H+=2NH3或N2+6e-+8H+=2NH4+。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示的转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )
![]()
A.X可能为Al或Cl2
B.Y一定为NaOH(aq)
C.N一定是HCl(aq)
D.Q、Z中的一种必为Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧锌锰电池中的黑锰粉(MnO2、MnO(OH)、NH4Cl、少量ZnCl2及炭黑、氧化铁等)为原料制备MnCl2,实现锰的再利用。其工作流程如下:
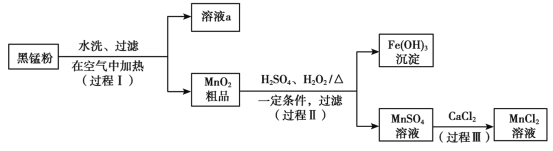
(1)过程Ⅰ中,在空气中充分加热黑锰粉的目的主要是除去__________和氧化锰元素,请写出含Mn元素的物质发生反应的化学方程式____________________________。
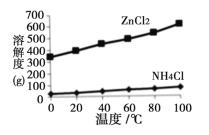
(2)溶液a的主要成分为NH4Cl,另外还含有少量ZnCl2等。根据右图所示的溶解度曲线,将溶液a经___________、_______________、过滤可得NH4Cl粗品。
(3)检验MnSO4溶液中是否含有Fe3+:取少量溶液,加入____________(填试剂和现象),证明溶液中Fe3+沉淀完全。
(4)探究过程Ⅱ中MnO2溶解的适宜条件。
ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
①用化学方程式表示ⅱ中MnO2溶解的原因:__________________。
②解释试剂加入顺序不同,MnO2作用不同的原因:_______________________。
上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol N2和 3 mol H2充入体积可变的恒温密闭容器中,在380 ℃下发生反应:N2(g)+3H2(g)![]() 2NH3(g),平衡时,体系中氨的体积分数
2NH3(g),平衡时,体系中氨的体积分数![]() (NH3)随压强变化的情况如下表:
(NH3)随压强变化的情况如下表:
压强/MPa | 10 | 20 | 30 | 40 |
| 0.30 | 0.45 | 0.54 | 0.60 |
下列说法正确的是( )
A.10 MPa时,H2的转化率为75%
B.20 MPa时,NH3的物质的量浓度是10 MPa时的1.5倍
C.40 MPa时,若容器的体积为V L,则平衡常数K=![]()
D.30 MPa时,若向容器中充入惰性气体,则平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气![]() 进行此实验,所用仪器如图:
进行此实验,所用仪器如图:
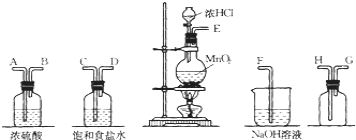
![]() 连接上述仪器的正确顺序是:____________。
连接上述仪器的正确顺序是:____________。
![]() 气体发生装置中进行的反应化学方程式是 ______ ;当
气体发生装置中进行的反应化学方程式是 ______ ;当![]() 参与反应时,被氧化的HCl的质量为 ______ 。
参与反应时,被氧化的HCl的质量为 ______ 。
![]() 在装置中:
在装置中:![]() 饱和食盐水的作用是 ______。
饱和食盐水的作用是 ______。
![]() 化学实验中检验是否有
化学实验中检验是否有![]() 产生常用湿润的淀粉
产生常用湿润的淀粉![]() 试纸
试纸![]() 如果有
如果有![]() 产生,可观察到的现象是 ______ ,写出反应方程式 ______ 。
产生,可观察到的现象是 ______ ,写出反应方程式 ______ 。
![]() 写出尾气吸收装置中进行的反应的化学方程式 ______ 。
写出尾气吸收装置中进行的反应的化学方程式 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱是一种非常重要的化工原料,在玻璃、肥料、合成洗涤剂等工业中有着广泛的应用。工业上“候氏制碱法”以NaCl、NH3、CO2及水等为原料制备纯碱,其反应原理为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。生产纯碱的工艺流程示意图如下:
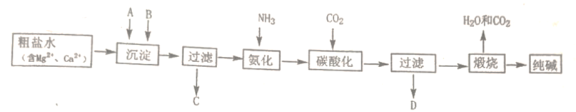
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。A_____________,B_____________。
(2)碳酸化后过滤,滤液D最主要的成分是__________(填写化学式),检验这一成分的阴离子的具体方法是: ______。
(3)该工艺流程中可回收再利用的物质是_______。
(4)产品纯碱中含有碳酸氢钠,如果取m1 kg纯碱加热分解后剩余固体质量为m2 kg,纯碱中碳酸氢钠的质量分数可表示为:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某品牌饮用矿物质水标签的部分内容。下列说法正确的是

A. 标签上给出的离子的物理量是物质的量浓度
B. 任何饮用水中氯离子(Cl-)的浓度均在10~27.3 mg/L之间
C. 该品牌饮用矿物质水中c(Mg2+)的最大值为2×10-4 mol/L
D. 一瓶该品牌饮用矿物质水中SO42-的物质的量不超过1×10-5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的有几个 ( )
①重水的化学式为T2O
②CO2的比例模型:![]()
③H2O2的电子式:![]()
④硅酸盐Ca2 Mg5 Si8 O22(OH)2可用氧化物形式表示为:2CaO﹒5MgO﹒8SiO2 ﹒H2O
⑤硅胶有吸水性,是常用的食品干燥剂
⑥医疗上常用乙醇体积分数为95%的酒精杀菌消
⑦聚四氟乙烯耐酸碱腐蚀,可用作化工反应器的内壁涂层
⑧水中的钢闸门连接电源的负极属于牺牲阳极的阴极保护法
⑨食盐可作调味剂,也可作食品防腐剂
A.1B.2C.3D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C6H6O)是一种重要的化工原料,广泛用于制造树脂、医药等。
Ⅰ.以A、B为原料合成扁桃酸衍生F的路线如下。

(1)A的名称是____;B的结构简式是____。
(2)C(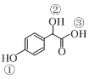 )中①~③羟基氢原子的活性由强到弱的顺序是____。
)中①~③羟基氢原子的活性由强到弱的顺序是____。
(3)D的结构简式是____。
(4)写出F与过量NaOH溶液反应的化学方程式:___________。
(5)若E分子中含有3个六元环,则E的结构简式是________。
Ⅱ.以A为原料合成重要的医药中间体K的路线如下。
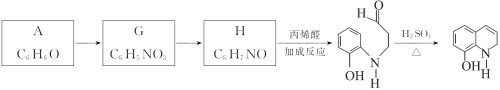
(6)G→H的反应类型是__________。
(7)一定条件下,K与G反应生成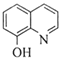 、H和水,化学方程式是__________。
、H和水,化学方程式是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com