
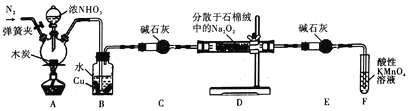
【题目】亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。某小组制备亚硝酸钠的实验装置如图所示(部分夹持装置已略去)。
已知:
①2NO+Na2O2=2NaNO2、2NaNO2+O2=2NaNO3
②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O
③酸性条件下,NO或NO2都能与MnO4-反应生成NO3-和Mn2+
回答下列问题:
(1)反应前需先打开弹簧夹,通入氮气排尽装置中的空气,原因是__________________。
(2)装置A中反应的化学方程式为_________________;装置B中的实验现象为_____________,铜片逐渐溶解并有气泡产生。
(3)若省略装置C,则装置D中的固体产物除NaNO2、NaOH外,还有__________、___________(填化学式)。检验产物中含有NaNO2的方法是:取少量样品于试管中,_____________________,则说明产物中含有NaNO2。
(4)装置E的作用是___________________________。
(5)NaNO2有像食盐一样的咸味,但能引起中毒。已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O。根据上述反应,可以用试剂和生活中常见的物质进行实验,以鉴别亚硝酸钠和食盐。进行实验时,除样品外必须选用的物质有_________(填标号)。
a.白酒 b.碘化钾、淀粉溶液 c.白醋 d.白糖
(6)充分反应后,该小组设计实验检测产物中NaNO2的含量。称取装置D中固体2.3000g,完全溶解配制成溶液l00mL,取出25.00mL溶液用0.100mol·L-1酸性KMnO4溶液进行滴定(杂质不与KMnO4反应),三次滴定平均消耗KMnO4溶液30.00mL,则样品中NaNO2的质量分数为_______________。(已知:NaNO2的摩尔质量为69g·mol-1)
【答案】 NO会被空气氧化为NO2 C+4HNO3(浓)![]() CO2↑ +4NO2↑+2H2O 红棕色气体变为无色,溶液变蓝 Na2CO3 NaNO3 加入稀盐酸,若产生无色气体并在试管口变为红棕色 防止水蒸气从装置F进入D中 bc 90.0%
CO2↑ +4NO2↑+2H2O 红棕色气体变为无色,溶液变蓝 Na2CO3 NaNO3 加入稀盐酸,若产生无色气体并在试管口变为红棕色 防止水蒸气从装置F进入D中 bc 90.0%
【解析】分析:本题考查NaNO2的制备、物质的检验与鉴别、NaNO2质量分数的测定、N及其化合物的性质、Na2O2的性质。根据装置图,A装置中木炭与浓硝酸共热反应生成CO2、NO2和H2O;将生成的气体通入B装置中,NO2与水反应生成HNO3和NO,Cu与稀HNO3反应生成Cu(NO3)2、NO和H2O;Na2O2能与CO2、H2O反应,在C装置中,气体中的CO2和H2O(g)被碱石灰吸收,得到干燥纯净的NO;D装置中NO与Na2O2反应制得NaNO2;由于Na2O2能与H2O反应,E中碱石灰的作用是防止水蒸气从装置F进入D中;根据已知③,F中酸性KMnO4用于吸收尾气。由于NO能与O2反应生成NO2,所以实验前必须排尽装置中的空气。根据反应“3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O”检验NaNO2。根据反应“2NaNO2+4HI=2NO↑+I2+2NaI+2H2O”,鉴别NaNO2和NaCl,选择碘化钾、淀粉溶液和白醋。根据NaNO2与酸性KMnO4溶液的反应计算NaNO2的质量,进一步计算NaNO2的质量分数。
详解:(1)由于NO能与O2反应生成NO2,所以实验前必须排尽装置中的空气。反应前需先打开弹簧夹,通入N2排尽装置中的空气,原因是:NO会被空气氧化成NO2。
(2)装置A中木炭与浓HNO3共热反应生成CO2、NO2和H2O,反应的化学方程式为C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O。装置B中发生的反应为:3NO2+H2O=2HNO3+NO、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,装置B中的实验现象为:红棕色气体变为无色,溶液变蓝,铜片逐渐溶解并有气泡产生。
CO2↑+4NO2↑+2H2O。装置B中发生的反应为:3NO2+H2O=2HNO3+NO、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,装置B中的实验现象为:红棕色气体变为无色,溶液变蓝,铜片逐渐溶解并有气泡产生。
(3)若省略装置C,通入装置D中的NO混有CO2、H2O(g),装置D中发生的反应有:2NO+Na2O2=2NaNO2、2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2、2NaNO2+O2=2NaNO3,装置D中的固体产物除NaNO2、NaOH外,还有Na2CO3、NaNO3。根据已知②:3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O,NaNO2与HCl反应产生无色的NO气体,NO遇空气会变为红棕色;检验产物中含有NaNO2的方法是:取少量样品于试管中,加入稀盐酸,若产生无色气体并在试管口变为红棕色,则说明产物中含NaNO2。
(4)由于Na2O2能与H2O反应,装置E的作用是:防止水蒸气从装置F进入D中。
(5)亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O,该反应的离子方程式为2NO2-+4H++2I-=2NO↑+I2+2H2O,NaCl与HI不反应;鉴别NaNO2和食盐的实验操作为:分别取两种固体少许于两支试管中,溶于水,向其中加入白醋、KI和淀粉溶液,溶液变蓝的为NaNO2,无明显现象的为NaCl;所以鉴别NaNO2和食盐,除样品外必须选用的物质是KI、淀粉溶液和白醋,答案选bc。
(6)NaNO2与酸性KMnO4溶液反应时,NO2-被氧化成NO3-,MnO4-被还原成Mn2+,根据得失电子守恒,2n(NaNO2)=5n(KMnO4),25.00mL溶液中n(NaNO2)=![]() n(KMnO4)=
n(KMnO4)=![]() 0.100mol/L
0.100mol/L![]() 0.03L=0.0075mol,2.3000g固体中n(NaNO2)=0.0075mol
0.03L=0.0075mol,2.3000g固体中n(NaNO2)=0.0075mol![]() =0.03mol,m(NaNO2)=0.03mol
=0.03mol,m(NaNO2)=0.03mol![]() 69g/mol=2.07g,样品中NaNO2的质量分数为
69g/mol=2.07g,样品中NaNO2的质量分数为![]() 100%=90.0%。
100%=90.0%。


科目:高中化学 来源: 题型:
【题目】烃A是一种重要的有机化工原料,其相对分子质量Mr(A),90<Mr(A)<110。取一定量A在足量氧气中完全燃烧后,生成的CO2和H2O的物质的量之比为2:1;A能使溴的四氯化碳溶液褪色,红外光谱显示A分子中有苯环。有机物间的转化关系如图:
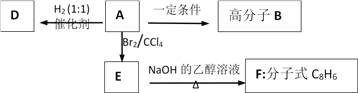
(1)A的实验式为_________;A的相对分子质量为_________;A的官能团的名称为_______________。
(2)A→B的反应方程式为______________________________________。反应类型为______________。
(3)用有机物D的同系物制取炸药TNT的反应方程式为______________________________________。
(4)E→F的反应方程式为__________________________________________。
(5)有机物甲为A的同系物,符合下列两个条件的甲的结构有____种(包括立体异构)。
① 甲的相对分子质量比A大14,②苯环上只有一条侧链。 其中核磁共振氢谱有五组峰,峰面积之比为1:2:2:2:3的物质结构简式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4L苯所含的碳碳双键数为3NA
B.常温常压下,1mol乙烯所含电子数为12NA
C.1mol金属钠在足量乙醇中完全反应转移的电子数为NA
D.在1L 1mol·L-1的乙酸溶液中含乙酸分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列气态分子BCl3、CCl4、H2O和BeCl2中,其键角由大到小的顺序为________。
(2)硫化氢(H2S)分子的空间构型为________;二氧化碳(CO2)分子的空间构型为________;甲烷(CH4)分子的空间构型为________。
(3)由于氨水和次氯酸盐溶液在弱碱性介质中反应可生成氯胺(H2NCl),分子结构类似于NH3,H2NCl分子的空间构型为________,电子式为________,H2NCl中氯的化合价为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在含有大量PbI2的饱和溶液中存在平衡:PbI2(s)![]() Pb2+(aq)+2I-(aq),向该饱和溶液中加入KI浓溶液,下列说法正确的是
Pb2+(aq)+2I-(aq),向该饱和溶液中加入KI浓溶液,下列说法正确的是
A. 溶液中Pb2+和I-的浓度都增大 B. PbI2的溶度积常数Ksp增大
C. 沉淀溶解平衡向右移动 D. 溶液中Pb2+的浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯磺酰氰酯(结构简式为 )是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
)是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
(1)基态钴原子的核外电子排布式为________________。组成HClO4-NaClO4的4种元素的电负性由小到大的顺序为____________________。
(2)氯磺酰氰酯分子中硫原子和碳原子的杂化轨道类型分别是____________、___________, 1个氯磺酰氰酯分子中含有σ键的数目为______________,氯磺酰氰酯中5种元素的第一电离能由大到小的顺序为_________________。
(3)ClO4-的空间构型为__________________。
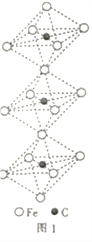
(4)一种由铁、碳形成的间隙化合物的晶体结构如图1所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为________________。
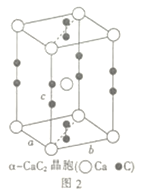
(5)电石(CaC2)是制备氯化氰(ClCN)的重要原料。四方相碳化钙(CaC2)的晶胞结构如上图2所示,其晶胞参数分别为a、b、c,且a=b,c=640pm。已知四方相碳化钙的密度为1.85g·cm-3,[C≡C]2-中键长为120pm,则成键的碳原子与钙原子的距离为________pm和_______pm。(设阿伏加德罗常数的数值为6×1023)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案能达到目的的是( )
A. 用品红溶液检验SO2
B. 用焰色反应鉴别KNO3和KCl
C. 用澄清石灰水鉴别MgCl2溶液和NaHCO3溶液
D. 用丁达尔效应区分FeCl3溶液和Fe2(SO4)3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com