
【题目】柠檬酸(用H3R表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的含量随pH的变化如图所示。下列说法正确的是
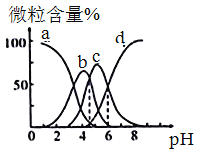
A. H3R的第二步电离常数Ka2(H3R)的数量级为10-4
B. Na2HR溶液中HR2-的水解程度大于电离程度
C. pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
D. pH=4时,c(H+)=c(H2R-)+2c(HR2-)+c(OH-)
【答案】C
【解析】
柠檬酸是三元弱酸,在溶液电离方程式:H3R![]() H2R-+H+,H2R-
H2R-+H+,H2R-![]() HR2-+H+,HR2-
HR2-+H+,HR2-![]() R2-+H+,随着pH值的增大,氢离子浓度会减小,平衡向右移动,所以H3R含量会减少。H3R、H2R-、HR2-、R3-在图形中表示的曲线分别为a、b、c、d,据此回答。
R2-+H+,随着pH值的增大,氢离子浓度会减小,平衡向右移动,所以H3R含量会减少。H3R、H2R-、HR2-、R3-在图形中表示的曲线分别为a、b、c、d,据此回答。
A.柠檬酸溶液电离方程式:H3R![]() H2R-+H+,H2R-
H2R-+H+,H2R-![]() HR2-+H+,HR2-
HR2-+H+,HR2-![]() R2-+H+,第二步电离常数Ka2(H3R)=
R2-+H+,第二步电离常数Ka2(H3R)=![]() ,数量级为10-5,故A错误;
,数量级为10-5,故A错误;
B.根据图示知道Na2HR溶液显示酸性,说明HR2-的水解程度小于电离程度,B错误;
C. 根据图示,随着溶液pH值的增大,c(H+)逐渐减小,平衡向右移动,所以H3R含量会减少。H3R、H2R-、HR2-、R3-在图形中表示的曲线分别为a、b、c、d,pH=6时,溶液显示酸性,由于酸电离作用大于水的电离作用,所以c(R3-)=c(HR2-)>c(H+)>c(OH-),C正确;
D.pH=4时,根据电荷守恒:c(H+)=c(H2R-)+2c(HR2-)+ c(OH-)+ c(R3-), D错误。
故合理选项是C。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
【题目】下列有关装置图的叙述中正确的是

A. 用装置①给铜镀银,则b极为单质银,电解质溶液为AgNO3溶液
B. 装置②的总反应式:Cu + 2Fe3+ = Cu2+ + 2Fe2+
C. 装置③中钢闸门应与电源的负极相连被保护,该方法叫做外加电流的阴极保护法
D. 装置④中插入海水中的铁棒,越靠近底端腐蚀越严重
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿付加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L H2与O2的混合气体所含原子数为2NA
B.1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C.15 g C2H6中含有共价键数目为7NA
D.1 mol Na2O2与足量CO2充分反应转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】830K时,在密闭容器中发生下列可逆反应CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0。试回答下列问题:
CO2(g)+H2(g) △H<0。试回答下列问题:
(1)若起始时c(CO)=2mol·L—1,c(H2O)=3mol·L—1,达到平衡时CO的转化率为60%,则平衡常数K=_____________,此时水蒸气的转化率为______________。
(2)在相同温度下,若起始时c(CO)=1mol·L—1,c(H2O)=2mol·L—1,反应进行一段时间后,测得H2的浓度为0.5mol·L—1,则此时该反应是否达到平衡状态_____(填“是”或“否”),此时v(正)__v(逆)(填“>”“<”或“=”)。
(3)若降低温度,该反应的K值将___________,化学反应速率将______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
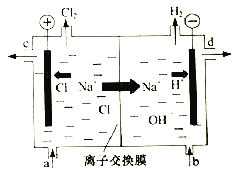
完成下列填空:
(1)写出电解饱和食盐水的离子方程式________________________________。
(2)阳极发生的是____________反应、阴极发生的是________反应(填“氧化”或“还原”)。
(3)精制饱和食盐水从图中________位置补充,氢氧化钠溶液从图中________位置流出。(选填“a”、“b”、“c”或“d”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2在一定条件下可以合成乙醇(CH3CH2OH):2CO(g)+4H2(g) ![]() CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
A. CO全部转化为乙醇
B. 正反应和逆反应的化学反应速率均为零
C. 反应体系中乙醇的物质的量浓度不再变化
D. CO和H2以1:2的物质的量之比反应生成乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某元素原子的价电子构型为4s24p1,该元素的符号为________。
(2)某元素+3价离子的3d轨道半充满,该元素的符号为________。
(3)A元素的负二价离子和B元素的正二价离子的电子层结构都与氩相同,A的离子结构示意图为________,B的元素名称为________。
(4)如图,第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。如图是部分元素原子的第一电离能I1随原子序数变化的曲线(其中12~17号元素的有关数据缺失)。
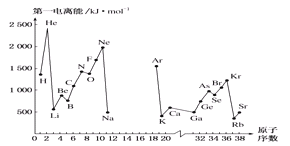
①认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围为________<Al<________;(填元素符号)。
②图中第一电离能最小的元素在周期表中的位置是第________周期________族。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料。下列说法一定正确的是( )

A. 该电池工作时,电子的流向外电路由A到B,内电路由B到A形成闭合回路
B. 电极B附近的HNO3浓度增大
C. A电极的反应为:NO2-e-+H2O==NO3-+2H+ NO-3e-+2H2O===NO3-+4H+
D. 该电池工作时,每消耗11.2LO2(标准状况下),可以除去含1molNO和NO2的混合尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学利用下图装置对电化学原理进行了一系列探究活动。

(1)甲池为装置_______(填“原电池”或“电解池”)。
(2)甲池反应前,两电极质量相等,一段时间后,两电极质量相差28g,导线中通过_________mol电子。
(3)实验过程中,甲池左侧烧杯中NO3-的浓度_______(填“变大”、“变小”或“不变”)。
(4)其他条件不变,若用U形铜棒代替“盐桥”,工作一段时间后取出铜棒称量,质量___________(填“变大”、“变小”或“不变”)。若乙池中的某盐溶液是足量AgNO3溶液,则乙池中左侧Pt电极反应式为___________________________________,工作一段时间后,若要使乙池溶液恢复原来浓度,可向溶液中加入_____________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com