
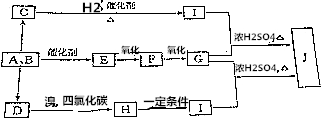
分析 有机物J对H2的相对密度是59,则其相对分子质量为59×2=118,分子中N(C)=$\frac{118×40.68%}{12}$=4,N(H)=$\frac{118×5.08%}{1}$=6,N(O)=$\frac{118-12×4-6}{16}$=4,故J的分子式为C4H6O4.碳和水蒸气反应生成A、B的混合气体为CO与H2混合气体,A与B按不同比例反应可生成C、D、E.其中D是一种植物生长调节剂,用于催熟果实,则D为CH2=CH2,D与溴发生加成反应生成H为BrCH2CH2Br,H发生水解反应生成I为HOCH2CH2OH.F是一种无色、有刺激性气味的气体,是家庭装修常见污染物,可知F为HCHO,则E为CH3OH,G为HCOOH.甲酸与乙二醇发生酯化反应生成J为HCOOCH2CH2OOCH.C可分别与钠和银氨溶液反应,C与氢气反应得到HOCH2CH2OH,可推知C为HOCH2CHO.
解答 解:有机物J对H2的相对密度是59,则其相对分子质量为59×2=118,分子中N(C)=$\frac{118×40.68%}{12}$=4,N(H)=$\frac{118×5.08%}{1}$=6,N(O)=$\frac{118-12×4-6}{16}$=4,故J的分子式为C4H6O4.碳和水蒸气反应生成A、B的混合气体为CO与H2混合气体,A与B按不同比例反应可生成C、D、E.其中D是一种植物生长调节剂,用于催熟果实,则D为CH2=CH2,D与溴发生加成反应生成H为BrCH2CH2Br,H发生水解反应生成I为HOCH2CH2OH.F是一种无色、有刺激性气味的气体,是家庭装修常见污染物,可知F为HCHO,则E为CH3OH,G为HCOOH.甲酸与乙二醇发生酯化反应生成J为HCOOCH2CH2OOCH.C可分别与钠和银氨溶液反应,C与氢气反应得到HOCH2CH2OH,可推知C为HOCH2CHO.
(1)由上述分析可知,J的分子式为:C4H6O4,故答案为:C4H6O4;
(2)E的结构简式为CH3OH,C的结构简式为HOCH2CHO,
故答案为:CH3OH;HOCH2CHO;
(3)配制银氨溶液的操作:在洁净的试管里加入少量的AgNO3溶液,然后一边摇动试管,一边逐滴滴入稀氨水,至最初产生的沉淀恰好溶解为止,
故答案为:在洁净的试管里加入少量的AgNO3溶液,然后一边摇动试管,一边逐滴滴入稀氨水,至最初产生的沉淀恰好溶解为止;
(4)G+I→J的化学反应方程式为:2CH3OH+HCOOH$→_{△}^{浓硫酸}$HCOOCH2CH2OOCH+2H2O,属于取代反应,
D→H的化学反应方程式为:CH2=CH2+Br2→BrCH2CH2Br,属于加成反应,
故答案为:2CH3OH+HCOOH$→_{△}^{浓硫酸}$HCOOCH2CH2OOCH+2H2O,取代反应;CH2=CH2+Br2→BrCH2CH2Br,加成反应;
(5)J为HCOOCH2CH2OOCH,两种属于酯类且与J互为同分异构体的结构简式为:CH3OOC-COOCH3、HCOOCH2OOCHCH3等,
故答案为:CH3OOC-COOCH3、HCOOCH2OOCHCH3.
点评 本题考查有机物的推断与合成、有机反应方程式书写、限制条件同分异构体书写等,熟练掌握官能团的性质与转化,难度不大.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 铝粉与氧化镁共热可制取金属镁 | |
| B. | 铝分别与足量的 HCl溶液、足量的NaOH的溶液反应,产生的氢气前者多 | |
| C. | 可用Na2SiO3溶液和CO2反应来制备H2SiO3 | |
| D. | NaOH溶液可以盛装在带玻璃塞的磨口试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的消耗量是3.0mol | |
| B. | N2的平均速率是0.5mol•(L•min)-1 | |
| C. | N2的平衡浓度是1.0mol•L-1 | |
| D. | N2反应的量占原物质的量的百分数是50% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
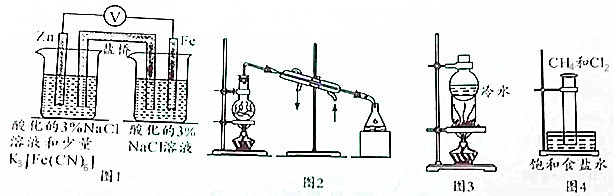
| A. | 用图1所示装置验证牺牲阳极的阴极保护法 | |
| B. | 用图2所示装置可在实验室制备蒸馏水 | |
| C. | 用图3所示装置可以进行NaCl与NH4Cl、NaCl与I2的分离 | |
| D. | 用图4所示装置进行CH4取代反应的实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中3个碳原子在同一直线上 | B. | 分子中所有原子在同一平面上 | ||
| C. | 与HCl加成只生成一种产物 | D. | 能与Cl2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
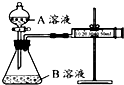 某实验小组利用 KMnO4 酸性溶液与弱酸 H2C2O4溶液反应进行“外界因素对反应速率 影响”的探究,设计实验方案如下:
某实验小组利用 KMnO4 酸性溶液与弱酸 H2C2O4溶液反应进行“外界因素对反应速率 影响”的探究,设计实验方案如下:| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.2mol/L-1 H2C2O4溶液 | 4mL 0.01mol/L-1 KMnO4溶液 |
| ② | 2mL 0.1mol/L -1H2C2O4溶液 | 4mL 0.01mol/L-1 KMnO4溶液 |
| 实验 编号 | 温度/℃ | 烧杯中所加的试剂及其用量 (mL) | 加入 少量固体 | 溶液褪色 时间(s) | |||
| 0.6mol•L-1 H2C2O4溶液 | H O | 0.2mol•L-1 KMnO4溶液 | 3mol•L-1 稀硫酸 | ||||
| ① | 25 | 30.0 | 20.0 | 30.0 | 20.0 | 无 | 1.8 |
| ② | 50 | V1 | V2 | 30.0 | 20.0 | 无 | 1.0 |
| ③ | 25 | 15.0 | V3 | 15.0 | 10.0 | 无 | 3.6 |
| ④ | 25 | 30.0 | 20.0 | 30.0 | 20.0 | K2SO4 | 1.8 |
| ⑤ | 25 | 30.0 | 20.0 | 30.0 | 20.0 | MnSO4 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积/mL | 20.7 | 20.12 | 20.00 | 19.88 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜是人类最早利用的金属之一,铜能形成多种重要的化合物.
铜是人类最早利用的金属之一,铜能形成多种重要的化合物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com