
【题目】下列实验操作和实验结论均正确的是
实验操作 | 实验结论 | |
A | 先加少量氯水,再滴加KSCN溶液,出现血红色 | 证明某溶液中存在Fe2+ |
B | 向AgCl悬浊液中加入NaI溶液时出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
C | 向碳酸钙中滴加盐酸,有气泡产生 | 证明氯的非金属性大于碳 |
D | 将MgCl2溶液在氯化氢的气流中蒸发、结晶、过滤 | 制备氯化镁晶体 |
A. A B. B C. C D. D
【答案】D
【解析】
A,先加氯水,再滴加KSCN溶液出现血红色,说明加氯水后的溶液中含Fe3+,Fe3+可能是原溶液中的也可能是氯水氧化得到的,不能说明溶液中一定含Fe2+,A项错误;B,向AgCl悬浊液中加入NaI溶液时出现黄色沉淀,说明AgCl转化成AgI,根据沉淀转化的一般原则,Ksp(AgCl)![]() Ksp(AgI),B项错误;C,CaCO3中滴加盐酸有气泡产生,说明发生了反应CaCO3+2HCl=CaCl2+CO2↑+H2O,根据“强酸制弱酸”的复分解反应规律得出酸性:HCl
Ksp(AgI),B项错误;C,CaCO3中滴加盐酸有气泡产生,说明发生了反应CaCO3+2HCl=CaCl2+CO2↑+H2O,根据“强酸制弱酸”的复分解反应规律得出酸性:HCl![]() H2CO3,HCl不是Cl的最高价含氧酸,不能得出Cl和C非金属性的强弱,C项错误;D,在MgCl2溶液中存在水解平衡:MgCl2+2H2O
H2CO3,HCl不是Cl的最高价含氧酸,不能得出Cl和C非金属性的强弱,C项错误;D,在MgCl2溶液中存在水解平衡:MgCl2+2H2O![]() Mg(OH)2+2HCl,在HCl气流中蒸发,抑制MgCl2的水解,制得氯化镁晶体,D项正确;答案选D。
Mg(OH)2+2HCl,在HCl气流中蒸发,抑制MgCl2的水解,制得氯化镁晶体,D项正确;答案选D。


科目:高中化学 来源: 题型:
【题目】如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )

A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某同学设计了如下实验流程:在一个小烧杯里,加入20g Ba(OH)2·8H2O晶体和10gNH4Cl晶体,然后将小烧杯放在事先已滴有3滴~4滴水的玻璃片上,并立即用玻璃棒迅速搅拌。实验流程示意图如下,回答下列问题:
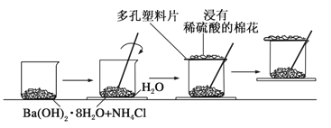
①实验中玻璃棒的作用是_______。
②浸有稀硫酸的棉花的作用是______。
(2)沼气是一种廉价能源,农村存在大量的秸秆、杂草等废弃物,它们经微生物发酵之后,便可产生沼气,可用来点火做饭。在农村推广建造沼气池,不仅能有效地利用____能,还能为农业生产提供优良的肥料。已知:标准状况下的112.0LCH4气体完全燃烧,生成CO2和液态水,放出4448kJ的热量。
①写出CH4完全燃烧的热化学方程式为________。
②如果上述反应生成的是水蒸气,则反应放出的热量___4448kJ。(填“>”或“<”或“=”)
(3)钢铁在潮湿的空气中生锈主要是由电化学腐蚀造成的,发生腐蚀时铁和内部的杂质碳及钢铁表面的电解质溶液形成原电池。钢铁发生吸氧腐蚀时正极的电极反应式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库。
Ⅰ.从海水中提取食盐和溴![]() 海水中溴以溴化钠为主
海水中溴以溴化钠为主![]() 的过程如下:
的过程如下:
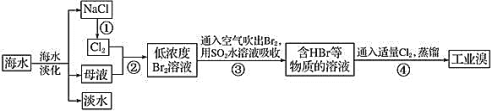
(1)工业上是利用步骤①所得的NaCl固体制备金属钠的化学方程式为:______。
(2)步骤②的离子方程式为:________。
(3)步骤③用![]() 水溶液吸收
水溶液吸收![]() ,可制得两种强酸,化学方程式为:_____。
,可制得两种强酸,化学方程式为:_____。
Ⅱ.海洋植物如海带、海藻中含有丰富的碘元素,燃烧的灰烬中碘元素以![]() 的形式存在。实验室里从海藻中提取碘的流程如下:
的形式存在。实验室里从海藻中提取碘的流程如下:
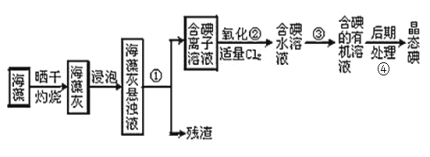
(4)指出提取碘的过程中有关的实验操作名称:
①_____③_____④______
(5)提取碘的过程中,可供选择的有机试剂是_____(填字母)。
A.苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式,正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中,发生可逆反应mA(g) + nB(g) ![]() pC(g) + qD(g),当m、n、p、q为任意整数时,反应达到平衡的标志是( )
pC(g) + qD(g),当m、n、p、q为任意整数时,反应达到平衡的标志是( )
②体系温度不再改变
③各组分的浓度不再改变
④各组分的质量分数不再改变
⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
⑥单位时间内m mol A断键反应,同时p mol C也断键反应
⑦体系的密度不再变化
A.③④⑤⑥ B.②③④⑥
C.①③④⑤ D.③④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知KMnO4和H2C2O4(草酸)在酸性溶液中会发生氧化还原反应。甲、乙两个实验小组欲探究影响化学反应速率的因素,设计实验方案如下(实验中所用KMnO4溶液均已酸化)
(1)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率,实验装置如图所示:

实验时仪器中的A溶液一次性加入,A、B的成分见下表:
序号 | A溶液 | B溶液 |
① | 2 mL 0.1 mol·L-1H2C2O4溶液 | 4 mL 0.01 mol·L-1KMnO4溶液 |
② | 2 mL 0.2 mol·L-1H2C2O4溶液 | 4 mL 0.01 mol·L-1KMnO4溶液 |
③ | 2 mL 0.2 mol·L-1H2C2O4溶液 | 4 mL 0.01 mol·L-1KMnO4溶液,少量MnSO4固体(催化剂) |
①盛放A溶液的仪器名称_______,锥形瓶中反应的化学方程式:______
②该实验探究的是_____因素对化学反应速率的影响。在反应停止之前,相同时间内针筒中所得CO2的体积由大到小的顺序是____(填实验序号)。
(2)乙组:通过测定KMnO4溶液褪色所需时间的长短来比较化学反应速率。
取两支试管各加入2 mL 0.1 mol·L-1H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol·L-1KMnO4溶液,将四支试管分成两组(每组各有一支试管盛有H2C2O4溶液和KMnO4溶液),一组放入冷水中,另一组放入热水中,一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究________因素对化学反应速率的影响,但该组同学始终没有看到溶液完全褪色,其原因是______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如图装置进行中和热的测定,请回答下列问题:

(1)做1次完整的中和热测定实验,温度计至少需使用________次,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么?_______________。
(2)实验室用50 mL 0.50 mol·L-1盐酸,50 mL 0.55 mol·L-1 NaOH溶液进行测定中和热的实验,为了把测量数据记录下来,请你设计表格__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com