
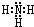 .
.分析 X、Y、Z、L、M五种元素的原子序数依次增大,X、Y、Z、L是组成蛋白质的基础元素,故X为H元素,Y为C元素,Z为N元素,L为O元素,M是地壳中含量最高的金属元素,M为Al元素.
(1)同周期随原子序数增大原子半径减小,电子层越多原子半径越大;
(2)Z、X两元素原子数目比1:3和2:4构成分子A和B,则A为NH3,B为N2H4,NH3中N原子与H原子之间形成1对共用电子对,N原子含有1对孤对电子;
(3)Se的最高化合价为+6,结合硫酸的分子式书写最高价氧化物对应的水化物化学式;
同主族自上而下非金属性减弱,单质与氢气反应剧烈程度减小,反应热增大(考虑符号);
(4)Z的最简单气态氢化物甲的水溶液成碱性,甲为NH3,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生的产物不污染环境,则反应生成氮气与水.
解答 解:X、Y、Z、L、M五种元素的原子序数依次增大,X、Y、Z、L是组成蛋白质的基础元素,故X为H元素,Y为C元素,Z为N元素,L为O元素,M是地壳中含量最高的金属元素,M为Al元素.
(1)同周期随原子序数增大原子半径减小,电子层越多原子半径越大,故原子半径:Al>C>N>O>H,
故答案为:Al>C>N>O>H;
(2)Z、X两元素原子数目比1:3和2:4构成分子A和B,则A为NH3,B为N2H4,NH3中N原子与H原子之间形成1对共用电子对,N原子含有1对孤对电子,电子式为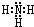 ,
,
故答案为: ;
;
(3)Se与O元素同族元素,Se的最高化合价为+6,最高价氧化物对应的水化物化学式为H2SeO4,同主族自上而下非金属性减弱,单质与氢气反应剧烈程度减小,反应热增大(考虑符号),故生成1mol硒化氢(H2Se)反应热应排在第二位,应为+29.7kJ•mol-1,故选b,
故答案为:H2SeO4;b;
(4)Z的最简单气态氢化物甲的水溶液成碱性,甲为NH3,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生的产物不污染环境,则反应生成氮气与水,反应方程式为:2NH3•H2O+2H2O2=N2↑+8H2O,
故答案为:2NH3•H2O+2H2O2=N2↑+8H2O.
点评 本题考查结构性质位置关系、元素周期律、反应热比较等,注意(3)中根据反应的剧烈程度程度判断.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Li+、Na+、Al3+、K+ | B. | F2、Cl2、Br2、I2 | C. | F-、Cl-、Br-、I- | D. | Li、Na、K、Rb |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸亚铁加过氧化氢溶液离子方程式为:Fe2++H2O2+2H+═Fe3++2H2O | |
| B. | 碘水中通入足量的SO2离子方程式为:I2+SO2+2H2O═2I-+SO42-+4H+ | |
| C. | 在碳酸氢钠溶液中:K+、Al3+、SO42-、Cl-可大量共存 | |
| D. | 使紫色石蕊试液呈红色的溶液中:Na+、K+、CO32-、NO3-可大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
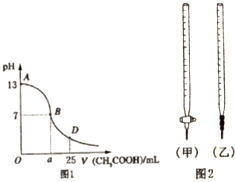
| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 酚酞 | (甲) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 石蕊 | (乙) |
| D | 酸 | 碱 | 石蕊 | (乙) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不同的化学反应,限度可能不同 | |
| B. | 可以通过改变反应物浓度来控制化学反应的限度 | |
| C. | 可以通过延长化学反应的时间来改变反应的限度 | |
| D. | 催化剂不能控制化学反应的限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y与X、Z、W分别能形成两种化合物 | |
| B. | Z与W形成的Z2W型化合物在水溶液中Z+离子与W2-离子个数比为2:1 | |
| C. | Y、Z、W不可能形成水溶液呈碱性的化合物 | |
| D. | 化合物X Y2、X YW、X W2随着共价键的键长逐渐增大,熔沸点逐渐降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
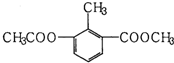
| A. | 一个分子中含有12个H原子 | |
| B. | 能使酸性KMnO4溶液褪色 | |
| C. | 苯环上的一氯代物有2种 | |
| D. | 1mol该物质分别与足量H2、NaOH溶液反应,消耗其物质的量均为3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
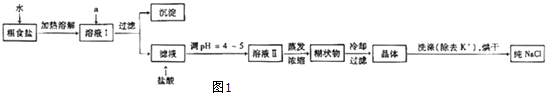
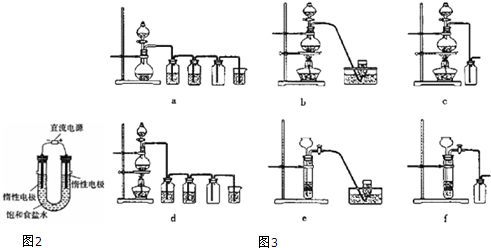
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com