
����Ŀ�������Ѱ۳����ᣨ��Ҫ�����ᡢFe3+��Fe2+��TiO2+��Al3+���Ʊ����������[(NH4)2S2O8]��ͬʱ����TiO(OH)2�ļ�Ҫ�������£�
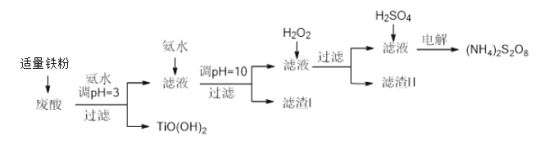
��֪��i.����������ȫ�����������������pH��
�������� | TiO2+ | Fe3+ | Fe2+ | Al3+ |
��ʼ������PH | 1.2 | 1.9 | 7.0 | 3.2 |
������ȫ��pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7ʱ��Fe2+��������Fe(II)��������[Fe(NH3)2]2+��
��ش��������⣺
��1��������������������________________________��
��2������TiO(OH)2�Ļ�ѧ����ʽ��____________________��
��3������I���������о����е����ʵĻ�ѧʽ��________
��4������H2O2��Ŀ������������Fe(II)��������[Fe(NH3)2]2+����ƽ�������ӷ���ʽ��2[Fe(NH3)2]2++____________+4H2O +H2O2=___________+ 4NH3��H2O��
��5�������£����Һ�к�������Ҫ������ʽ��pH�Ĺ�ϵ����ͼ��ʾ��
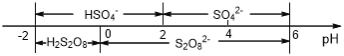
�������ŵ��������ҪΪHSO4-���������������Һ��pH��ΧΪ_________
��6����֪Ksp[Al(OH)3]=3.2��10-34 ����pH=10 ʱ������Һ��c(Al3+)=___________
��7��25�棬pH=3��(NH4)2SO4��Һ�У�����2c(SO42-)- c(NH4+) =___________����ʽ���ɣ�
���𰸡���Fe3+ ��ԭ��Fe2+������Fe3+ ��TiO2+ ͬʱ���� TiOSO4+2 NH3��H2O=(NH4)2SO4 +TiO(OH)2 �� Fe(OH)3 4OH- 2Fe(OH)3 0��PH��2 3.2��10-22 10-3-10-11
��������
�������̽�������Ϣ������Һ�����۷�Ӧ����Fe2+������pH=3ʹTiO2+����TiO(OH)2�������ڵ���pH=10��ʹFe2+������������������������������Ӵ��������������ɣ�pH>7ʱ��Fe2+��������Fe(II)��������[Fe(NH3)2]2+������������⣬����Ϊ���������������������ᣬ�������(NH4)2S2O8��
��1������Һ�к���Fe3+����������������Fe3+��Ӧ����Fe2+������Fe3+ ��TiO2+ ͬʱ������
��2��TiO2+�백ˮ��Ӧ����TiO(OH)2������笠����ӣ�����ʽΪTiOSO4+2 NH3��H2O =(NH4)2SO4 +TiO(OH)2 ����
��3������pHΪ10ʱ����Һ�е�Fe2+��Ϊ�����������������������������ֱ�����Ϊ����������������IΪ����������������������pH>7ʱ��Fe2+��������Fe(II)��������[Fe(NH3)2]2+�������������ʱ��+2��Fe��Ϊ+3��������������������������Ϊ����������������I���������о����е�����ΪFe(OH)3��
��4��H2O2��Fe(II)��������[Fe(NH3)2]2+��Ӧ������������������һˮ�ϰ�������ʽΪ2[Fe(NH3)2]2++4OH-+4H2O +H2O2= 2Fe(OH)3+ 4NH3��H2O��
��5���������̿�֪�����������IJ���Ϊ(NH4)2S2O8����HSO4-�ŵ磬���ͼ���֪��pH�ķ�ΧΪ0��pH��2��
��6����֪Ksp[Al(OH)3]=c(Al3+)��c3(OH-)=3.2��10-34 ��pH=10ʱ��c(OH-)=��10-4 mol/L�������ϵʽ����c(Al3+)=3.2��10-22 mol/L��
��7��������Һ�ʵ����ԣ�c(NH4+) +c(H+)=2c(SO42-)+c(OH-)����2c(SO42-)- c(NH4+) = c(H+)- c(OH-)=10-3-10-11 mol/L��


 �Ͻ�ƽСѧ��������ϵ�д�
�Ͻ�ƽСѧ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����мס��ҡ��������ĸ�װ�ã�����˵������ȷ����
A. װ�ü���Ϊ��ȡNO2�ķ���װ��
װ�ü���Ϊ��ȡNO2�ķ���װ��
B. װ���ҿ���Ϊ��ȡNO���ռ�װ��
װ���ҿ���Ϊ��ȡNO���ռ�װ��
C.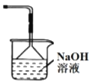 װ�ñ�����Ϊ��ȡCl2��β������װ��
װ�ñ�����Ϊ��ȡCl2��β������װ��
D. װ�ö������ڳ�ȥNH3��H2O
װ�ö������ڳ�ȥNH3��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������͵Ŀ�����Լ�� 17���� 1��2һ�������顣ijѧϰС������ͼ��ʾװ���Ʊ����� 1��2 һ�������飬������������: 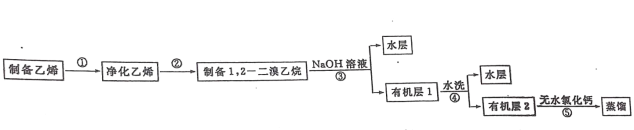
��֪��1��2 һ��������ķе�Ϊ131�棬�۵�Ϊ9.3�档��1��2 һ����������Ʊ����ۢ١��ڵ�ʵ��װ��Ϊ��
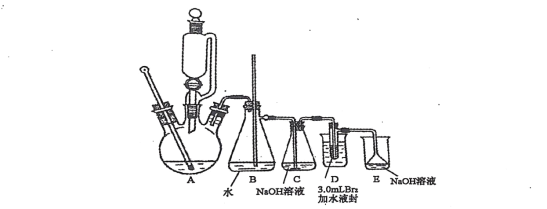
ʵ�鲽�裺
(��)�ڱ�ˮ��ȴ�£��� 24mL Ũ��������ע��12mL�Ҵ��л�Ͼ��ȡ�
(��)�� D װ�õ��Թ��м���3.0mL Һ��(0.10mol)��Ȼ���������ˮҺ�⣬�����ձ��м�����ȴ����
(��)�������������������ԡ���������ƿ�м������Ƭ��ͨ����Һ©������һ����Ũ�������Ҵ��Ļ���һ�������ڵ�Һ©���С�
(��)���ж�ƿC��ƿD�����Ӵ�����������ƿ�����¶�������Լ120�棬����ƿ C��ƿD�����¶����ߵ�180��200�棬ͨ����Һ©������������Һ��
(V)��������������ƿ����Dװ�����Թ��ڵ���ɫ��ȫ��ȥ���ж�ƿC��ƿD�����Ӵ�����ֹͣ���ȡ��ش���������:
(1)ͼ�� B װ�ò����ܵ�����Ϊ__________________________________________��
(2)(��)�������ж�ƿC��ƿD�����Ӵ����ټ�������ƿ����ԭ����__________________________________________��
(3)װ��D���ձ����������ȴ����������ȴ�����ʵ�Ϊ__________________________________________��
a.��ˮ����� b.5���ˮ c.10���ˮ
��1��2 һ��������Ĵ���
����ۣ���ȴ��װ�� D �Թ��еIJ���ת������Һ©���У��� 1������������ˮ��Һϴ�ӡ�
����ܣ���ˮϴ�����ԡ�
����ݣ��������õ��л����м���������ˮ�Ȼ��ƣ����ˣ�ת����������ƿ�������ռ�
130��132�����֣��õ���Ʒ5.64g��
(4)������м��� 1������������ˮ��Һʱ��������Ӧ�����ӷ���ʽΪ__________________________________________��
(5)������м�����ˮ�Ȼ��Ƶ�����Ϊ_________________________����ʵ�����ò�Ʒ�IJ���Ϊ__________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������![]() ʱijЩ���ʵ��ܽ��
ʱijЩ���ʵ��ܽ��![]() ���ݣ�
���ݣ�
|
|
|
|
|
|
|
|
����˵������ȷ���ǣ� ��
A.̼��þ����Һ�д���![]()
![]()
![]()
B.��![]() ��Һ���ݹ�¯�е�ˮ�����ɽ�ˮ���е�
��Һ���ݹ�¯�е�ˮ�����ɽ�ˮ���е�![]() ת��Ϊ
ת��Ϊ![]()
C.��![]() ����Һ�еμ�
����Һ�еμ�![]() ��������Ϊ���ɫ��˵���ܽ��
��������Ϊ���ɫ��˵���ܽ��![]()
D.��2mL����![]() ��Һ���Ⱥ�μ�
��Һ���Ⱥ�μ�![]() ��
��![]() ��NaOH��Һ��2�Σ������İ�ɫ����ֻ��
��NaOH��Һ��2�Σ������İ�ɫ����ֻ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ksp(AgCl)=1.8��10-10��Ksp(AgI)=1.0��10-16�����й���������֮��ת����˵���д������( )
A.AgCl������ˮ������ת��ΪAgI
B.�����������Ksp���Խ���������Խ����ת��Ϊ�����ܵ�����
C.AgI��AgCl��������ˮ������AgCl����ת��ΪAgI
D.�����£�AgCl��Ҫ��NaI��Һ�п�ʼת��ΪAgI����NaI��Ũ�ȱ��벻����![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH4N3(�������)������ը��Ӧ��NH4N3![]() 2N2����2H2����NAΪ�����ӵ�������ֵ������˵����ȷ����
2N2����2H2����NAΪ�����ӵ�������ֵ������˵����ȷ����
A.1.8 g NH4+�к��е�������Ϊ1mol
B.N2��������������ǻ�ԭ����
C.6 g NH4N3�����к��е�������Ϊ0.1mol
D.��ը��Ӧ�У���ת��4mol����ʱ������89.6 L�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ�����Ԫ�ص�������ͼ������˵����ȷ����
![]()
A.BiԪ�ص�������Ϊ209B.BiԪ�������ڱ��е�λ��λ�ڵ�������IIIA��
C.Biԭ����3��δ�ɶԵ���D.Biԭ���������5��������ͬ�ĵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������еij����л���ķ���ʽ���ṹʽ���ṹ��ʽ�������й�˵����ȷ����
��![]() ��
��![]() ��
��![]() ��
��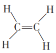 ��CH3CH2OH��C6H12O6��CH3COOH��Ӳ֬��������ᵰ���ʢ����ϩ
��CH3CH2OH��C6H12O6��CH3COOH��Ӳ֬��������ᵰ���ʢ����ϩ
A.�ܸ�������Ȼ�̼��Һ�����ӳɷ�Ӧ��ʹ֮��ɫ���Т٢ڢܢ�
B.��̼����ߡ��ж���������ΪҺ���ҵ�ȼʱ��Ũ�̵��Ǣ�
C.���ڸ߷��Ӳ��ϵ��Ǣ���
D.Ͷ�����ܲ���H2���Ǣݢߢ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ�������ֵ������˵����ȷ����
A.���³�ѹ�£�3.2 g 18O2������ԭ����Ϊ0.2NA
B.��״���£�18 g H2O��������ԭ����ĿΪNA
C.�����£�8g CH4�к���5NAԭ��
D.���³�ѹ�£�1 mol CO2��SO2�Ļ�������к�ԭ����Ϊ2NA
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com