
| A. | 萃取 | B. | 蒸馏 | C. | 分液 | D. | 渗析 |
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 A>B>D>C | |
| B. | 原子序数 d>c>b>a | |
| C. | 离子半径 C>D>B>A | |
| D. | 原子结构的最外层电子数目 A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原 | |
| B. | 没有单质参加的反应一定不是氧化还原反应 | |
| C. | 置换反应一定是氧化还原反应 | |
| D. | 化合反应一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
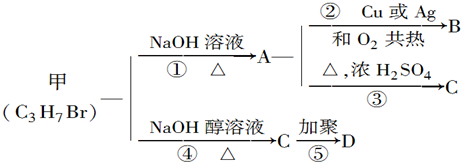
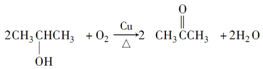

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量碳酸钠粉末 | B. | 加入少量硫酸铜溶液 | ||
| C. | 加入适量NaCl溶液 | D. | 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2 | B. | Na2CO3 | C. | 氯水 | D. | NaClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com