
【题目】化学与生活密切相关,下列生活现象中没有发生化学变化的是
A. 过氧乙酸可用于环境消毒
B. 漂白粉消毒
C. 夜晚霓虹灯放出五颜六色的光
D. 醋除水垢
科目:高中化学 来源: 题型:
【题目】食品化学家A.Saari Csallany和Christine Seppanen说,当豆油被加热到油炸温度(185 ℃)时会产生如下图所示的高毒性物质,许多疾病都与这种有毒物质有关,如帕金森症。下列关于该有毒物质的判断不正确的是( )

A. 该物质可以发生加成反应 B. 该物质的分子式为C8H15O2
C. 该物质的分子中含有三种官能团 D. 该物质属于烃的衍生物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表中短周期的一部分,其中Y元素的核电荷数为M与N元素核电荷数之和。下列说法正确的是

A.氢化物稳定性:N>Z,因为N的氢化物中存在氢键
B.简单离子半径:N>X,是因为它们具有相同的电子层结构且X的核
电荷数更大
C.元素的非金属性:M>Y,是因为M单质能与YN2反应生成Y单质
D.熔沸点:YN2>MN2,是因为YN2的分子间作用力强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,物质的量浓度均为1mol/L的下列溶液,盐酸、硫酸、醋酸,导电能力由强到弱的顺序是( )
A. 盐酸=硫酸=醋酸 B. 盐酸>硫酸>醋酸 C. 硫酸>盐酸>醋酸 D. 醋酸>盐酸>硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境污染影响人类生存,治理污染是化学工作者研究的重要课题。
Ⅰ.汽车尾气主要成分有CO、SO2、氮氧化物等,科学家目前正尝试用二氧化钛(TiO2)催化分解汽车尾气。
(1)已知:2NO(g)+O2==2NO2(g) ΔH1=113.0 kJmol1
2SO2(g)+O2(g)==2SO3(l) ΔH2=288.4 kJmol1
请判断反应NO2(g)+SO2(g)==NO(g)+SO3 (l),在低温下能否自发进行,并说明理由 。
(2)已知TiO2催化汽车尾气降解的原理为:
2CO(g)+O2(g)![]() 2CO2(g);4NO(g)+3O2(g)+2H2O(g)
2CO2(g);4NO(g)+3O2(g)+2H2O(g)![]() 4HNO3(g)。
4HNO3(g)。
①在O2浓度几乎不变的条件下,模拟CO、NO的降解,得到降解率随时间变化如图1所示。反应40秒后检测到混合气体中N2浓度明显上升而HNO3(g)浓度有所降低,请用化学方程式并结合化学反应原理解释出现该现象的可能原因 。


②图2为在不同颗粒间隙的沥青混凝土(α、β型)和不同温度下,实验进行相同一段时间(t秒)后测得的CO降解率变化。已知50℃、t秒时容器中O2浓度为0.01 molL1,求此温度下在α型沥青混凝土中CO降解反应的平衡常数 。
③下列关于图2 的说法不正确的是 。
A.根据降解率由b到c随温度的升高而增大,可知CO降解反应的平衡常数Kb<Kc
B.相同温度下β型沥青混凝土中CO降解速率比α型要大
C.a点的数据反映出CO与O2之间所发生的有效碰撞频率是整个实验过程中最高的
D.d点降解率出现突变的原因可能是温度升高后催化剂失效
Ⅱ.对燃煤烟气的脱硫、脱硝处理是环境科学研究的热点。
(3)工业上采用尿素[CO(NH2)2]湿法进行脱硫和脱硝,其过程表示如下:

①上述过程中脱硫反应的化学方程式为 。
②尿素溶液中存在如下反应:CO(NH2)2(aq)+H2O![]() NH2COONH4(aq) (ΔH<0),研究表明,增大溶液中NH2COONH4的浓度会使脱硫速率明显加快,因此工业生产中常将温度控制在60℃左右,原因是:温度过低,该反应进行很慢,使溶液中NH2COONH4的含量较少; (请将原因补充完整)。
NH2COONH4(aq) (ΔH<0),研究表明,增大溶液中NH2COONH4的浓度会使脱硫速率明显加快,因此工业生产中常将温度控制在60℃左右,原因是:温度过低,该反应进行很慢,使溶液中NH2COONH4的含量较少; (请将原因补充完整)。
③工业上常用NaOH溶液吸收法脱硝,化学方程式为:NO+NO2+2NaOH==2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O,现有平均组成为NOx的NO、NO2混合气体,通入足量的NaOH溶液中,充分反应后没有气体剩余,则x的取值范围为 ;反应后溶液中n(NO2)︰n(NO3)= (用含x的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下反应:①木炭与水制备水煤气,②氯酸钾分解,③炸药爆炸,④酸与碱
的中和反应,⑤生石灰与水作用制熟石灰,⑥Ba(OH)2·8H2O 与NH4Cl,属于
放热反应_________(填序号),写出反应⑥的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应A2(g)+B2(g)![]() 2AB(g),达到反应限度的标志是( )
2AB(g),达到反应限度的标志是( )
A. 容器内气体的总压强不随时间的变化而变化
B. 单位时间内有nmolA2生成,同时就有nmolB2生成
C. 单位时间内有nmolA2生成,同时就有2nmolAB生成
D. 单位时间内有nmolB2发生反应,同时就有2nmolAB生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g) ![]() 2HI(g) △H<0,并在10min时达到平衡。HI的体积分数
2HI(g) △H<0,并在10min时达到平衡。HI的体积分数![]() (HI)随时间变化如图所示曲线(Ⅱ)。
(HI)随时间变化如图所示曲线(Ⅱ)。
(1)在此条件下,下列能说明该反应达到平衡状态的是___________(填序号)。
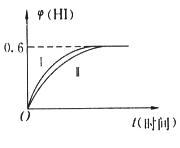
A.混合气体密度不再变化
B.反应混合物中H2的浓度不变
C.混合气体的颜色不再变化
D.每消耗1molH2同时消耗1molI2
(2)在达平衡过程中用HI(g)表示的反应速率为___________;I2(g)的平衡转化率为_______________。
(3)在此温度下,该反应的平衡常数K=_______(保留一位小数),若保持温度、体积不变,向已平衡的体系中再充入I2(g)和HI(g)各1mol,此时平衡___________(填“向左移动”“向右移动”或“不移动”)。
(4)若改变反应条件,在某条件下![]() (HI)的变化如曲线(Ⅰ)所示,则该条件可能是____________(填序号)。
(HI)的变化如曲线(Ⅰ)所示,则该条件可能是____________(填序号)。
①恒容条件下,降低温度
②恒温条件下,缩小反应容器体积
③恒温条件下,扩大反应容器体积
④恒温、恒容条件下,加入适当催化剂
(5)若保持温度不变,在另一相同的2L密闭容器中加入amolI2(g)、 bmolH2(g)和cmolHI(g)(a、b、c均大于0),发生反应达平衡时,HI体积分数仍为0.60,则a、b、c的关系为__________________(用一个含a、b、c的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com