
| A£® | CuŗĶCu2OµÄĪļÖŹµÄĮæÖ®±ČĪŖ2£ŗ1 | |
| B£® | ²śÉśµÄNOŌŚ±ź×¼×“æöĻĀµÄĢå»żĪŖ4.48L | |
| C£® | ĻõĖįµÄĪļÖŹµÄĮæÅضČĪŖ2.6mol•L-1 | |
| D£® | CuŗĶCu2OÓėĻõĖį·“Ó¦ŗóŹ£ÓąHNO3ĪŖ0.2mol |
·ÖĪö A£®CuŗĶCu2O×é³ÉµÄ»ģŗĻĪļÓėĻ”ĻõĖį»ģŗĻ£¬»ģŗĻĪļĶźČ«ČܽāÉś³ÉNOŗĶCu£ØNO3£©2£¬¼ÓČėNaOHČÜŅŗŗóÉś³ÉCu£ØOH£©2³Įµķ£¬×ĘÉÕ³ĮµķÉś³ÉCuO£¬Ōņn£ØCuO£©=$\frac{32.0g}{80g/mol}$=0.4mol£¬ÉčCuµÄĪļÖŹµÄĮæĪŖxmol£¬Cu2OµÄĪļÖŹµÄĮæĪŖymol£¬øł¾ŻCuŌ×ÓŹŲŗć¼°¹ĢĢåÖŹĮæµĆ$\left\{\begin{array}{l}{x+2y=0.4}\\{64x+144y=27.2}\end{array}\right.$£¬½āµĆ$\left\{\begin{array}{l}{x=0.2}\\{y=0.1}\end{array}\right.$£»
B£®øł¾Ż×ŖŅʵē×ÓŹŲŗć¼ĘĖćÉś³ÉµÄNOŌŚ±źæöĻĀĢå»ż£»
C£®øł¾ŻCuŌ×ÓŹŲŗćµĆn[Cu£ØNO3£©2]=n£ØCuO£©=0.4mol£¬
n£ØNaOH£©=2n[Cu£ØNO3£©2]+n£ØHNO3£©£ØŹ£Óą£©£¬Ź£ÓąĻõĖįĪļÖŹµÄĮæ=1.0mol/L”Į1L-2”Į0.4mol=0.2mol£¬
øł¾ŻNŌ×ÓŹŲŗć¼ĘĖćn£ØHNO3£©=n£ØNO£©+2n[Cu£ØNO3£©2]+n£ØHNO3£©£ØŹ£Óą£©=0.2mol+2”Į0.4mol+0.2mol=1.2mol£¬ĻõĖįĪļÖŹµÄĮæÅضČ=$\frac{1.2mol}{0.5L}$=2.4mol/L£¬øł¾Żc=$\frac{n}{V}$¼ĘĖćĻõĖįĪļÖŹµÄĮæÅØ¶Č£»
D£®n£ØNaOH£©=n£ØHNO3£©£ØŹ£Óą£©+2n[Cu£ØNO3£©2]£¬¾Ż“Ė¼ĘĖćŹ£ÓąĻõĖįĪļÖŹµÄĮ森
½ā“š ½ā£ŗA£®CuŗĶCu2O×é³ÉµÄ»ģŗĻĪļÓėĻ”ĻõĖį»ģŗĻ£¬»ģŗĻĪļĶźČ«ČܽāÉś³ÉNOŗĶCu£ØNO3£©2£¬¼ÓČėNaOHČÜŅŗŗóÉś³ÉCu£ØOH£©2³Įµķ£¬×ĘÉÕ³ĮµķÉś³ÉCuO£¬Ōņn£ØCuO£©=$\frac{32.0g}{80g/mol}$=0.4mol£¬ÉčCuµÄĪļÖŹµÄĮæĪŖxmol£¬Cu2OµÄĪļÖŹµÄĮæĪŖymol£¬øł¾ŻCuŌ×ÓŹŲŗć¼°¹ĢĢåÖŹĮæµĆ$\left\{\begin{array}{l}{x+2y=0.4}\\{64x+144y=27.2}\end{array}\right.$£¬½āµĆ$\left\{\begin{array}{l}{x=0.2}\\{y=0.1}\end{array}\right.$£¬
ŌņCuŗĶCu2OµÄĪļÖŹµÄĮæÖ®±Č=0.2mol£ŗ0.1mol=2£ŗ1£¬¹ŹAÕżČ·£»
B£®øł¾Ż×ŖŅʵē×ÓŹŲŗć¼ĘĖćÉś³É±źæöĻĀV£ØNO£©=$\frac{0.2mol”Į2+0.1mol”Į2”Į1}{5-2}$”Į22.4L/mol=4.48L£¬¹ŹBÕżČ·£»
C£®øł¾ŻCuŌ×ÓŹŲŗćµĆn[Cu£ØNO3£©2]=n£ØCuO£©=0.4mol£¬
n£ØNaOH£©=2n[Cu£ØNO3£©2]+n£ØHNO3£©£ØŹ£Óą£©£¬Ź£ÓąĻõĖįĪļÖŹµÄĮæ=1.0mol/L”Į1L-2”Į0.4mol=0.2mol£¬
øł¾ŻNŌ×ÓŹŲŗć¼ĘĖćn£ØHNO3£©=n£ØNO£©+2n[Cu£ØNO3£©2]+n£ØHNO3£©£ØŹ£Óą£©=0.2mol+2”Į0.4mol+0.2mol=1.2mol£¬ĻõĖįĪļÖŹµÄĮæÅضČ=$\frac{1.2mol}{0.5L}$=2.4mol/L£¬¹ŹC“ķĪó£»
D£®n£ØNaOH£©=n£ØHNO3£©£ØŹ£Óą£©+2n[Cu£ØNO3£©2]£¬Ź£ÓąĻõĖįĪļÖŹµÄĮæ=1.0mol/L”Į1L-2”Į0.4mol=0.2mol£¬¹ŹDÕżČ·£»
¹ŹŃ”C£®
µćĘĄ ±¾Ģāæ¼²éŃõ»Æ»¹Ō·“Ó¦¼ĘĖć£¬ĪŖøßĘµæ¼µć£¬²ąÖŲæ¼²éѧɜ·ÖĪö¼ĘĖćÄÜĮ¦£¬Ć÷Č··“Ó¦ŹµÖŹ¼°ø÷øöĪļĄķĮæÖ®¼äµÄ¹ŲĻµŹĒ½ā±¾Ģā¹Ų¼ü£¬×¢ŅāŌ×ÓŹŲŗćŗĶ×ŖŅʵē×ÓŹŲŗćµÄĮé»īŌĖÓĆ£¬ĢāÄæÄѶČÖŠµČ£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
 £®
£®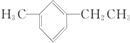 Ćū³ĘĪŖ1-¼×»ł-3-ŅŅ»ł±½£®
Ćū³ĘĪŖ1-¼×»ł-3-ŅŅ»ł±½£®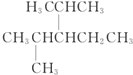 Ćū³ĘĪŖ£ŗ2£¬4-¶ž¼×»ł-3-ŅŅ»łĪģĶ飮
Ćū³ĘĪŖ£ŗ2£¬4-¶ž¼×»ł-3-ŅŅ»łĪģĶ飮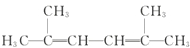 Ćū³ĘĪŖ£ŗ2£¬5-¶ž¼×»ł-2£¬4-¼ŗ¶žĻ©£®
Ćū³ĘĪŖ£ŗ2£¬5-¶ž¼×»ł-2£¬4-¼ŗ¶žĻ©£® £»
£»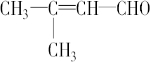 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
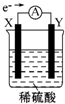 ČēĶ¼£¬ŌŚŹ¢ÓŠĻ”ĮņĖįµÄÉÕ±ÖŠ·ÅČėÓƵ¼ĻßĮ¬½ÓµÄµē¼«X”¢Y£¬ĶāµēĀ·ÖŠµē×ÓĮ÷ĻņČēĶ¼ĖłŹ¾£¬¹ŲÓŚøĆ×°ÖƵÄĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
ČēĶ¼£¬ŌŚŹ¢ÓŠĻ”ĮņĖįµÄÉÕ±ÖŠ·ÅČėÓƵ¼ĻßĮ¬½ÓµÄµē¼«X”¢Y£¬ĶāµēĀ·ÖŠµē×ÓĮ÷ĻņČēĶ¼ĖłŹ¾£¬¹ŲÓŚøĆ×°ÖƵÄĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©| A£® | ĶāµēĀ·µÄµēĮ÷·½ĻņĪŖX”śĶāµēĀ·”śY | |
| B£® | ČōĮ½µē¼«¶¼ŹĒ½šŹō£¬ŌņĖüĆĒµÄ»ī¶ÆŠŌĖ³ŠņĪŖX£¼Y | |
| C£® | X¼«ÉĻ·¢ÉśµÄŹĒ»¹Ō·“Ó¦£¬Y¼«ÉĻ·¢ÉśµÄŹĒŃõ»Æ·“Ó¦ | |
| D£® | SO42-ĻņXµē¼«ŅĘ¶Æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ÅØ¶Č | c£ØNH3£©£Ømol/L£© | c£ØO2£©£Ømol/L£© | c£ØNO£©£Ømol/L£© |
| ĘšŹ¼ | 0.8 | 1.6 | 0 |
| µŚ2min | 0.6 | a | 0.2 |
| µŚ4min | 0.3 | 0.975 | 0.5 |
| µŚ6min | 0.3 | 0.975 | 0.5 |
| µŚ8min | 0.7 | 1.475 | 0.1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĶØČė×ćĮæCO2ŗóµÄČÜŅŗÖŠ£ŗNa+”¢SiO32-”¢CH3COO-”¢SO32- | |
| B£® | ±„ŗĶĀČĖ®ÖŠ£ŗCl-”¢NO3-”¢Na+”¢SO32- | |
| C£® | c£ØH+£©=1”Į10-1 mol•L-1µÄČÜŅŗÖŠ£ŗCu2+”¢Al3+”¢SO42-”¢NO3- | |
| D£® | 0.1 mol•L-1 CH3COONaČÜŅŗ£ŗH+”¢Al3+”¢Cl-”¢NO3- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com