
分析 (1)NH4Cl为强酸弱碱盐,铵根离子水解导致溶液呈酸性;
(2)硫化钠溶液中硫离子分步水解,溶液显碱性分析离子浓度大小;
(3)一水合氨为弱电解质,不能完全电离,加水促进电离;
(4)0.1mol•L-1NaHCO3溶液的pH大于8,说明碳酸氢根离子的水解程度大于电离程度.
解答 解:(1)NH4Cl为强酸弱碱盐,铵根离子水解导致溶液呈酸性,水解方程式为NH4++H2O?NH3.H2O+H+,
故答案为:酸;NH4++H2O?NH3.H2O+H+;(10分)
(2)硫化钠溶液中硫离子分步水解,S2-+H2O?HS-+OH-,HS-+H2O?H2S+OH-,溶液中离子浓度大小为:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),向该溶液中加入少量固体CuSO4,发生反应的离子方程式为:Cu2++S2-=CuS↓,氢氧根离子浓度减小,溶液PH减小;
故答案为:(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+);减小;
(3)氨水为弱电解质,不能完全电离,如稀释相等体积,氨水溶液pH大,如稀释后溶液pH相同,则氨水应加入较多水,
故答案为:<;
(4)常温下,0.1mol•L-1NaHCO3溶液中存在电离和水解,离子方程式为:HCO3-?CO32-+H+、HCO3-+H20?H2CO3+OH-,的pH大于8,c(OH-)>c(H+),说明HCO3-水解程度大于其电离程度,故c(Na+)>c(HCO3-)、c(H2CO3)>c(CO32-),
故答案为:>;HCO3-?CO32-+H+、HCO3-+H20?H2CO3+OH-,HCO3-的水解程度大于电离程度.
点评 本题考查较为综合,涉及离子浓度大小比较、弱电解质的电离、盐类的水解等知识,为高考常见题型,难度中等,注意把握相关基本理论的理解和应用.


科目:高中化学 来源: 题型:选择题
| A. | 用溴水可鉴别苯、CCl4、苯乙烯 | |
| B. | 加浓溴水,然后过滤可除去苯中少量苯酚 | |
| C. | 苯、溴水、铁粉混合制成溴苯 | |
| D. | 鉴定溴乙烷中存在溴元素的实验操作是先加入NaOH溶液,加热后再加入AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅可用于制造光导纤维 | B. | 氯氧化钠用来治疗胃酸过多 | ||
| C. | 铝制容器可以用来贮运稀硝酸 | D. | 乙烯用作水果的催熟剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释 |
| A | H2S的沸点比H2O的高 | H2S的范德华力大于H2O的范德华力 |
| B | 白磷为正四面体分子 | 白磷分子中P-P-P的键角是109.5° |
| C | 1体积水可以溶解700体积氨气 | 氨是极性分子且有氢键的影响 |
| D | 键的极性:H-O>N-H | 非金属性差异越大,键的极性越小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
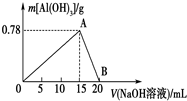 向20mL某物质的量浓度的AlCl3溶液中滴入2mol•L-1NaOH溶液时,得到的Al(OH)3沉淀质量与所滴加的NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
向20mL某物质的量浓度的AlCl3溶液中滴入2mol•L-1NaOH溶液时,得到的Al(OH)3沉淀质量与所滴加的NaOH溶液的体积(mL)关系如图所示,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5mol/L | B. | 1.25mol/L | C. | 2.5mol/L | D. | 3mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量相等、密度不同的N2和C2H4 | B. | 体积相等的CO和N2 | ||
| C. | 等温、等体积的O2和N2 | D. | 等压、等体积的N2和CH4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com