
分析 (1)根据生成的白色沉淀为硫酸钡,计算出4.42g复盐中含有的硫酸根离子的物质的量;
(2)根据4.42g复盐分解生成的氨气的物质的量计算出铵离子的物质的量;
(3)根据以上计算结果计算出铵离子与硫酸根离子数目之比,从而得出x;再根据计算出的x与计算出复盐的物质的量及y.
解答 解:(1)该复盐中的硫酸根离子与足量BaCl2溶液反应生成的6.99g沉淀为硫酸钡,则:n(SO42-)=n(BaSO4)=$\frac{6.99g}{233g/mol}$=0.03mol,
答:4.42g复盐CuSO4•x(NH4)2SO4•yH2O中SO42-物质的量为0.03mol;
(2)硫酸中氢离子的物质的量为:n(H+)=1mol•L-1×0.1L×2=0.2mol,氢氧化钠中和的硫酸中氢离子的物质的量为:2mol•L-1×0.08L=0.16mol,
则与NH3反应的H+的物质的量为:n(NH4+)=n(H+)=0.2mol-0.16mol=0.04mol,
答:4.42g复盐CuSO4•x(NH4)2SO4•yH2O中NH4+物质的量为0.04mol;
(3)根据计算可知:n(SO42-)=0.03mol、n(NH4+)=0.04mol,则n(NH4+):n(SO42-)=0.04:0.03=4:3,
即:2x:(x+1)=4:3,
解得:x=2,
复盐的化学式为CuSO4•2(NH4)2SO4•yH2O,根据硫酸根离子的物质的量可知,4.42g该复盐的物质的量为:$\frac{0.03}{2+1}$mol=0.01mol,
所以该复盐的摩尔质量为:M(复盐)=$\frac{4.42g}{0.01mol}$=442g•mol-1,
则:18y+64+96×3+18×4=442,解得:y=1,
答:该复盐中x=2、y=1.
点评 本题考查复盐化学式的确定,题目难度中等,注意掌握复杂化学式的方法,能够根据沉淀的质量、中和反应数据计算出铵根离子与硫酸根离子的物质的量是解题关键.


科目:高中化学 来源: 题型:多选题
| A. | 乙烯和苯都能使溴水褪色,褪色的原因不相同 | |
| B. | 天然氨基酸能与强酸或强碱溶液反应 | |
| C. | 豆油、甘油、汽油都属于酯类 | |
| D. | 乙烯、苯、纤维素均属于烃类化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
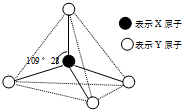 现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.请回答下列问题:
现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 1L某混合溶液,可能含有的离子如下表:
1L某混合溶液,可能含有的离子如下表:| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH4+、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、ClO-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2 | B. | CO和H2 | C. | NH3 | D. | CH3CH2OH(气) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 海水密度 | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C、N、Si | B. | N、P、O | C. | N、O、S | D. | C、Si、S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
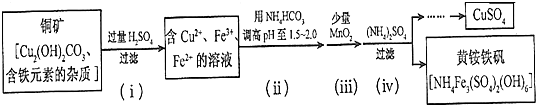
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com