
下列表示物质结构的化学用语或模型正确的是( )
A.N2的电子式: 
B.CO2的比例模型 
C.6个中子的碳原子的核素符号:12C
D.S2-的结构示意图: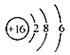
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源:2015-2016学年湖北省黄香、航天等校高二下学期期末联化学试卷(解析版) 题型:推断题
有机物W~H 有如下的转化关系。已知W、B为芳香族化合物,X为卤素原子,W、A、B、H均能与NaHCO3溶液反应,A分子中有2个甲基,H分子中含有醛基且苯环上的取代基处于对位。

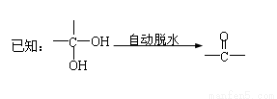
请回答下列有关问题:
(1)反应①属于 反应(填有机反应类型),A、B中均含有的含氧官能团的名称是 。
(2)B的结构简式 。
(3)写出D的同系物中含碳最少分子的结构简式: 。
(4)1molH在一定条件下与足量的氢气反应,消耗氢气的物质的量为: 。
(5)反应②的化学方程式是 。
(6)若
反应④的化学方程式是 。
(7)H有多种同分异构体,且满足下列3个条件: (i)遇FeCl3显紫色 (ⅱ)苯环上一取代物有两种 (ⅲ)除苯环外无其它环状结构。请任意写出1种符合条件的物质的结构简式______________________;
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省漳州市高二下期末化学试卷(解析版) 题型:选择题
下列反应中,不属于取代反应的是( )
A.乙醇与浓硫酸加热到140℃
B.苯与浓硝酸、浓硫酸混合共热制取硝基苯
C.乙醇与氧气反应生成醛
D.乙醇与浓硫酸、溴化钠共热
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一下学期期末化学试卷(解析版) 题型:选择题
下列实验操作与实验目的相符的是( )
序号 | 实验操作 | 实验目的 |
A | 测定HF、HCl的熔点、沸点 | 比较F、Cl的非金属性强弱 |
B | MgSO4、Al2(SO4)3溶液中分别滴加足量氨水 | 比较镁、铝的金属性强弱 |
C | 将SO2气体通入碳酸钠溶液中 | 比较碳、硫的非金属性强弱 |
D | 向氯化铵、氯化铝混合溶液中,滴加氢氧化钠溶液至过量 | 比较NaOH、NH3·H2O、Al(OH)3的碱性强弱 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一下学期期末化学试卷(解析版) 题型:选择题
下列A、B两种元素的原子序数,其中可以组成A2B型离子化合物的是 ( )
A. 6和8 B. 19和16 C. 12和17 D. 10和8
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二下学期期末化学试卷(解析版) 题型:实验题
(1)在仪器a 分液漏斗 b 试剂瓶 c 集气瓶 d 滴定管 e 容量瓶f 量筒 g 托盘天平中,标有“0”刻度的是________(填序号,有2个选项)。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺,在下列仪器中,没有用到“磨砂”工艺处理的有________(填序号,有2个选项)。
a.试管
b.分液漏斗
c.带滴管的试剂瓶(滴瓶)
d.碱式滴定管
e.酸式滴定管
(3)用装置甲、乙、丙和乳胶管组成一套装置(气密性已检查),可用于制取并收集NH3或HCl气体,可供选择的液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液。试回答下列问题:
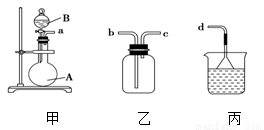
① 若制取某气体的过程中,丙中的石蕊溶液变红,且烧瓶中的试剂A与分液漏斗中的试剂B均为无色液体,则试剂A为________,制取该气体利用了B的性质有________、_____ 。
通过丙中紫色石蕊溶液变红或变蓝,说明乙中气体已集满。若石蕊溶液变蓝,则烧瓶甲中应加入的固体试剂A为________。
②若在乙中收集氨气,气体流经装置的顺序是:a→____→_____→d(填接口代号)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二下学期期末化学试卷(解析版) 题型:选择题
化学与生活密切相关,下列有关说法错误的是( )
A.用灼烧的方法可以区分蚕丝和人造纤维
B.食用油反复加热会产生稠环芳香烃等有害物质
C.加热能杀死流感病毒是因为蛋白质受热变性
D.医用消毒酒精中乙醇的浓度为95%
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高一下学期期末化学A卷(解析版) 题型:填空题
从能量的变化和反应的快慢等角度研究反应具有重要意义。
(1)已知反应2H2+O2 =2H2O为放热反应,下图能正确表示该反应中能量变化的是 。
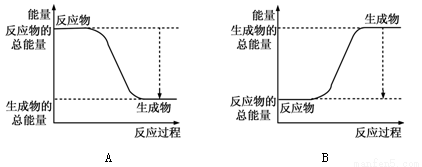
化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
从断键和成键的角度分析上述反应中能量的变化。化学键的键能如右表:则生成1mol水可以放出热量____________kJ
(2)原电池可将化学能转化为电能。将质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,设计成原电池,负极材料是 , 正极的反应式为 ,电解质溶液中SO42- 移向 极(填“正”或“负”)。一段时间后,取出洗净、干燥、称量,二者质量差为12.9 g。则导线中通过的电子的物质的量是 mol。
(3)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g)  xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南师大附中高一下学期末化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A. 元素周期律是元素原子核外电子排布周期性变化的结果
B. HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱
C. 第三周期非金属元素含氧酸的酸性从左到右依次增强
D. 形成离子键的阴、阳离子间只存在静电吸引力
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com