
| 离子 | 离子浓度(mol?L-1) | |
| 还原前 | 还原后 | |
| Fe2+ | 0.10 | 2.50 |
| SO42- | 3.50 | 3.70 |
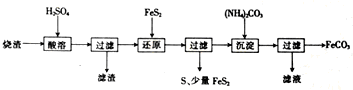
分析 烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)用硫酸浸取,过滤后滤液中含有硫酸铁、硫酸亚铁、未反应的硫酸,滤渣为二氧化硅,用二硫化亚铁矿还原Fe3+后过滤,得滤液中含有硫酸亚铁,向滤液中加入碳酸铵,过滤得碳酸亚铁,滤液中有硫酸铵,
(1)反应中元素化合价升高的失电子发生氧化反应做还原剂;
(2)过滤后滤液中含有硫酸铁、硫酸亚铁、未反应的硫酸,滤渣为二氧化硅;
(3)过滤得碳酸亚铁,滤液中有硫酸铵,所以检验FeCO3是否洗净,就是检验洗涤滤液中是否有硫酸根离子;“沉淀”时,pH过高时溶液中的亚铁离子会生成氢氧化亚铁,进而生成氢氧化铁,据此答题;
(4)①根据流程可知,“还原”时反应Ⅱ有硫产生,应为FeS2与铁离子之间的氧化还原反应,据此书写反应的离子方程式;
②根据表可知,反应Ⅰ中生成的硫酸根的浓度为0.2mol•L-1,据此计算出反应Ⅰ中被还原的Fe3+的物质的量浓度,同时计算出生成的亚铁离子的物质的量浓度,两个反应中共生成的亚铁离子的浓度为2.4mol•L-1,可求得反应Ⅱ中生成的亚铁离子,进而计算出Ⅰ、Ⅱ中生成的Fe2+的物质的量之比,据此答题.
解答 解:烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)用硫酸浸取,过滤后滤液中含有硫酸铁、硫酸亚铁、未反应的硫酸,滤渣为二氧化硅,用二硫化亚铁矿还原Fe3+后过滤,得滤液中含有硫酸亚铁,向滤液中加入碳酸铵,过滤得碳酸亚铁,滤液中有硫酸铵,
(1)反应Ⅰ为FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+,反应中硫元素化合价升高-1价变化为+6价,所以FeS2做还原剂,
故答案为:FeS2;
(2)过滤后滤液中含有硫酸铁、硫酸亚铁、未反应的硫酸,滤渣名称为二氧化硅,故答案为:二氧化硅;
(3)过滤得碳酸亚铁,滤液中有硫酸铵,所以检验FeCO3是否洗净,就是检验洗涤滤液中是否有硫酸根离子,所以操作为取少许最后一次洗涤液于试管中,滴加稀盐酸,待无明显现象后,再滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净.反之,则说明没洗涤干净,
故答案为:取少许最后一次洗涤液于试管中,滴加稀盐酸,待无明显现象后,再滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净.反之,则说明没洗涤干净;
(4)①根据流程可知,“还原”时反应Ⅱ有硫产生,应为FeS2与铁离子之间的氧化还原反应,据此书写反应的离子方程式,2Fe3++FeS2=2S↓+3Fe2+,
故答案为:2,1,2,3;
②根据表可知,反应Ⅰ中生成的硫酸根的浓度为0.2mol•L-1,据反应FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+可知,反应Ⅰ中被还原的Fe3+的物质的量浓度为1.4mol•L-1,同时计算出生成的亚铁离子的浓度为1.5mol•L-1,两个反应中共生成的亚铁离子的浓度为2.4mol•L-1,所以反应Ⅱ中生成的亚铁离子浓度为0.9mol•L-1,根据2Fe3++S2-=2Fe2++S↓可知,Ⅱ中被还原的Fe3+的物质的量浓度为0.9mol•L-1,所以反应Ⅰ、Ⅱ中生成Fe2+的物质的量之比=物质的量浓度之比=1.5:0.9=5:3,
故答案为:5:3;
点评 本题以化学工艺流程为载体,考查离子方程式书写、离子检验、热化学方程式书写、化学计算等,需要学生熟练掌握元素化合物知识,(4)中计算为易错点、难点,能较好的考查学生分析计算能力,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
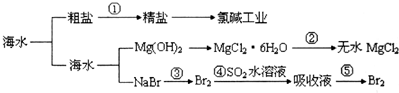
| A. | 第①步中除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 工业上金属钠是通过氯碱工业制取的 | |
| C. | ④和⑤步的目的是为了浓缩 | |
| D. | 第③④⑤步中溴元素均被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
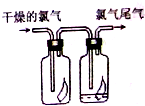 如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到右瓶的现象是:有色布条褪色,发生此现象的原因是Cl2+H2O?HCl+HClO.(用有关的方程式解释)
如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到右瓶的现象是:有色布条褪色,发生此现象的原因是Cl2+H2O?HCl+HClO.(用有关的方程式解释)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、HCO3- | B. | NH4+、Al3+、SO42- | C. | Na+、AlO2-、NO3- | D. | Cu2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
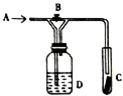 如图是一种试验某气体化学性质的实验装置,图中B为弹簧夹.在A处通入未经干燥的氯气,当打开弹簧夹B时,C中红色布条颜色褪去;当关闭弹簧夹B时,C中红色布条颜色无变化.则D瓶所盛的溶液是( )
如图是一种试验某气体化学性质的实验装置,图中B为弹簧夹.在A处通入未经干燥的氯气,当打开弹簧夹B时,C中红色布条颜色褪去;当关闭弹簧夹B时,C中红色布条颜色无变化.则D瓶所盛的溶液是( )| A. | 饱和NaCl溶液 | B. | 浓硫酸 | C. | 水 | D. | 稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
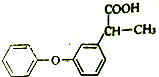 请按要求回答下列问题:
请按要求回答下列问题: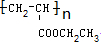 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2→Na2CO3→NaOH | B. | SiO2→Si→Na2SiO3 | ||
| C. | NH3→NO2→HNO3 | D. | S→SO2→NaHSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M<N<Y<X<Z | B. | Y<X<N<M<Z | C. | N<M<Y<X<Z | D. | X<Z<N<M<Y |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲苯分子中所有原子可能共平面 | |
| B. | 只有水就能区别苯、酒精、四氯化碳这三种无色液体 | |
| C. | 在化学反应过程中,发生物质变化的同时一定发生能量变化 | |
| D. | 埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更难被腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com