
【题目】电解饱和食盐水是氯碱工业基础。
(1)写出电解饱和氯化钠溶液时的总的离子反应方程式:________________________________________。
(2)当阴极产生1molH2时,通过阳离子交换膜的Na+有_________mol;
(3)产生的氯气可用于制TiCl4,但TiO2与Cl2难以直接反应,加碳生成CO、CO2可使反应得以进行。回答:
已知:TiO2(s) +2Cl2(g)=TiCl4(g)+O2(g) △H1=+175.4kJmol﹣1
2C(s) + O2(g)=2CO(g) △H2=﹣220.9kJmol﹣1
①TiO2与Cl2难以直接反应的原因是__________________________________________
②加碳生成CO、CO2后得以进行原因是________________________________________________________
(4)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
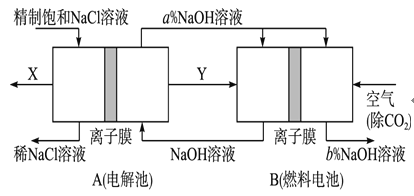
①图中Y是________ (填化学式);
②写出燃料电池B中负极上发生的电极反应:______________________________________________
③比较图示中氢氧化钠溶液质量分数的大小:a%_______b%(填>、=或<)
【答案】2Cl- + 2H2O![]() 2OH- + H2↑ + Cl2↑2 △H - TΔS>0TiO2(s) + 2Cl2(g) + 2C(s) = TiCl4(g) + 2CO(g) △H =-45.5kJmol﹣1,反应△H<0,△H - TΔS<0使反应得以进行H2H2 + 2OH- -2e- = 2H2O<
2OH- + H2↑ + Cl2↑2 △H - TΔS>0TiO2(s) + 2Cl2(g) + 2C(s) = TiCl4(g) + 2CO(g) △H =-45.5kJmol﹣1,反应△H<0,△H - TΔS<0使反应得以进行H2H2 + 2OH- -2e- = 2H2O<
【解析】
(1)电解饱和食盐水时,阳极上氯离子放电,阴极上氢离子放电;
(2)溶液中电荷守恒;
(3)①根据焓判据和熵判据判断反应的方向;
②TiO2(s) +2Cl2(g)=TiCl4(g)+O2(g) △H1=+175.4kJmol﹣1
2C(s) + O2(g)=2CO(g) △H2=﹣220.9kJmol﹣1
根据盖斯定律,两式相加得TiO2(s) + 2Cl2(g) + 2C(s) = TiCl4(g) + 2CO(g) △H =-45.5kJmol﹣1;
(4)①根据离子放电原理判断产物;突破口在于B燃料电池这边,通空气一边为正极(还原反应),那么左边必然通H2,这样Y即为H2;
②再转到左边依据电解饱和食盐水的化学方程式可知唯一未知的X必然为Cl2;A中的NaOH进入燃料电池正极再出来,依据O2+4e-+2H2O=4OH-可知NaOH浓度增大.;
③氢氧燃料电池最后产生的是水,溶液稀释。
(1)电解饱和食盐水时,阳极上氯离子放电,阴极上氢离子放电,同时溶液中生成氢氧化钠,所以电解池的总反应为:2Cl- + 2H2O![]() 2OH- + H2↑ + Cl2↑ ;
2OH- + H2↑ + Cl2↑ ;
(2)当阴极产生1molH2时,溶液中产生2molOH- ,通过阳离子交换膜的Na+有2mol;
(3)①根据焓判据和熵判据判断反应的方向:TiO2(s) +2Cl2(g)=TiCl4(g)+O2(g) △H1=+175.4kJmol﹣1,反应的△H1>0,ΔS<0,△H - TΔS>0。
②TiO2(s) +2Cl2(g)=TiCl4(g)+O2(g) △H1=+175.4kJmol﹣1
2C(s) + O2(g)=2CO(g) △H2=﹣220.9kJmol﹣1
根据盖斯定律,两式相加得TiO2(s) + 2Cl2(g) + 2C(s) = TiCl4(g) + 2CO(g) △H =-45.5kJmol﹣1,反应△H<0,△H - TΔS<0,故反应可自发进行;
(4)①电解饱和食盐水时,阳极上氯离子失电子生成氯气,阴极上氢离子得电子生成氢气,故Y为H2;
②氢氧燃料电池的电解质是碱时,电池总反应式均可表示为:2H2+O2=2H2O,其负极反应表示为:H2 + 2OH- -2e- = 2H2O;
③由于燃料电池正极发生O2+4e-+2H2O=4OH-,燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%小于b% 。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下面是几种常见的化学电源示意图,有关说法不正确的是

A. 上述电池分别属于一次电池、二次电池和燃料电池
B. 干电池在长时间使用后,锌筒被破坏
C. 铅蓄电池工作过程中,每通过2mol电子,负极质量减轻207g
D. 氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
科目:高中化学 来源: 题型:
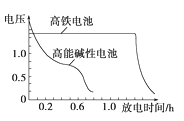
【题目】(1)高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图是高铁电池的模拟实验装置:

①该电池放电时正极的电极反应式为_______________________________________;若维持电流强度为1 A,电池工作十分钟,理论上消耗Zn______ g(计算结果保留一位小数,已知F=96500 C·mol-1)。
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向______(填“左”或“右”)移动;若用阳离子交换膜代替盐桥,则钾离子向________(填“左”或“右”)移动。
③下图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有__________。
(2)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是__________________________,A是________。

(3)利用原电池工作原理测定汽车尾气中CO的浓度,其装置如图所示。该电池中O2-可以在固体介质NASICON (固溶体)内自由移动,工作时O2-的移动方向________(填“从a到b”或“从b到a”),负极发生的电极反应式为__________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据所学知识,回答下列问题:
某学习小组用如下图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题。
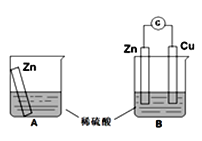
(1)B中Zn板是_________极,发生的电极反应是_________________,Cu板上的现象是___________;
(2)从能量转化的角度来看, A中是将化学能转变为_________,B中主要是将化学能转变为_________;
(3)该小组同学反思原电池的原理,其中观点正确的是_________;
A.原电池反应的过程中一定有电子转移
B.电极一定不能参加反应
C.原电池装置中的电子流向:负极→外线路→正极→电解质→负极
D.氧化反应和还原反应可以拆开在两极发生
(4)在B中,当导线中有1mol电子通过时,理论上的两极变化是_________。
A.锌片溶解32.5g B.锌片增重32.5g
C.铜片上析出2gH2 D.铜片上析出1mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能用离子方程式:H++OH-=H2O表示的是
A. 2NaOH+H2SO4=Na2SO4+2H2O
B. Ba(OH)2+2HCl=BaCl2+2H2O
C. KOH+HCl=KCl+H2O
D. Cu(OH)2+2HNO3= Cu(NO3)2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的工业加工过程中,可利用CO和H2合成用途广泛的化工原料甲醇,能量变化如图所示。下列说法正确的是

A. 该反应是吸热反应
B. 1molCH3OH所具有的能量为90.lkJ·mol-1
C. CO(g)+2H2(g) ![]() CH3OH(l) △H=-90.1kJ·mol-1
CH3OH(l) △H=-90.1kJ·mol-1
D. 1mol CO和2mol H2断键所需能量小于1mol CH3OH断键所需能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知自然界氧的同位素有16O、17O、18O,与氢的其中两种同位素H、D组成水分子,从水分子的原子组成来看,此水一共有
A.3种B.18种C.9种D.12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可以用下图所示的装置制取乙酸乙酯。回答下列问题:
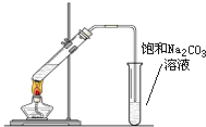
(1)在试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液,其方法是:_______;
(2)乙酸乙酯在饱和碳酸钠溶液的_______层;(填“上”或“下”)
(3)浓硫酸的作用是______________;
(4)制取乙酸乙酯的化学方程式是______,该反应属于___ (填反应类型)反应;
(5)饱和碳酸钠的作用是:________________;
(6)生成乙酸乙酯的反应是可逆反应,反应一段时间后,就达到了该反应的限度。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)_________。
①混合物中各物质的浓度不再变化;
②单位时间里,生成1mol乙醇,同时生成1mol乙酸;
③单位时间里,生成1mol乙酸乙酯,同时生成1mol 乙醇。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com