
【题目】氮及其化合物如NH3及铵盐、N2H4、N2O4等在中学化学、化工工业、国防等领域占有重要地位。
(1)已知反应NO2(g)+CO(g) = NO(g) +CO2(g)的能量变化如图所示,下列说法正确的是________。
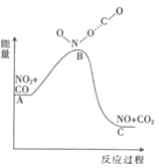
A.图中A→B的过程为放热过程
B.1molNO2和1molCO的键能总和大于1molNO和1molCO2的键能总和
C.该反应为氧化还原反应
D.1molNO2(g)和1molCO(g)的总能量低于1molNO(g)和1molCO2(g)的总能量
(2)N2O4与NO2之间存在反应N2O4(g)![]() 2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
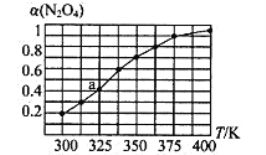
①由图推测该反应的△H___0(填“>”或“<”),理由为________________。
②图中a点对应温度下,已知N2O4的起始压强为108 kPa,则该温度下反应的平衡常数Kp=_________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系v( N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=___________,在下左图上标出的点中,能表示反应达到平衡状态的点为__________(填字母代号)。

(3)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。
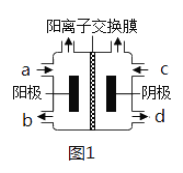
①收集到(CH3)4NOH的区域是______(填a、b、c或d)。
②写出电解池总反应(化学方程式)___________________________。
【答案】C > 温度升高,α(N2O4)增加,说明平衡右移。该反应为吸热反应,△H>0 115.2 k2×Kp/2 B点D点 d 2(CH3)4NCl+2H2O![]() 2(CH3)4NOH+H2↑+Cl2↑
2(CH3)4NOH+H2↑+Cl2↑
【解析】
(1)A、A→B能量升高,属于吸热过程,故A错误;
B、反应物的能量高于生成物的能量,此反应为放热反应,则1molNO2和1molCO的键能总和小于1molNO和1molCO2的键能总和,故B错误;
C、反应中C和N的化合价发生变化,则反应属于氧化还原反应,故C正确;
D、根据图像,反应物总能量高于生成物总能量,则1molNO2和1molCO的总能量高于1molNO和1molCO2的总能量,故D错误;
(2)①随着温度的升高,N2O4转化率增大,升高温度平衡向正反应方向进行,根据勒夏特列原理,正反应方向为吸热反应,即△H>0;
②令起始时N2O4物质的量为1mol,N2O4(g)![]() 2NO2(g)
2NO2(g)
起始: 1 0
变化: 0.4 0.8
平衡: 0.6 0.8 其他条件相同,压强之比等于物质的量之比,达到平衡时的压强为108×1.4/1kPa=151.2kPa,NO2的物质的量分数为0.8/(0.6+0.8)=4/7,N2O4的物质的量分数为3/7,根据平衡常数的定义,Kp=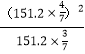 =115.2kPa;
=115.2kPa;
③化学平衡常数Kp=[p(NO2)]2/p(N2O4),利用速率之比等于化学计量数之比, v(N2O4)/v(NO2)=1/2,将公式代入,得出![]() =1/2,得出k1=k2×Kp/2;满足平衡条件,v(NO2)=2v(N2O4),即为平衡点,BD点的压强之比等于其反应速率之比的1:2,所以BD点为平衡点;
=1/2,得出k1=k2×Kp/2;满足平衡条件,v(NO2)=2v(N2O4),即为平衡点,BD点的压强之比等于其反应速率之比的1:2,所以BD点为平衡点;
(4)①以石墨为电极电解四甲基氯化铵制备四甲基氢氧化铵,需要OH-的参加,电解过程中阴极得到电子生成H2,得到OH-,收集到四甲基氢氧化铵的区域是阴极区,即d口;
②根据电解原理,电解过程中生成物为四甲基氢氧化铵、H2和Cl2,电解反应的化学方程式为2(CH3)4NCl+2H2O![]() 2(CH3)4NOH+H2↑+Cl2↑。
2(CH3)4NOH+H2↑+Cl2↑。


科目:高中化学 来源: 题型:
【题目】化学无处不在,下列说法错误的是( )
A. 《元丰行示德逢》里“雷蟠电掣云滔滔,夜半载雨输亭皋”涉及化学反应:N2+O2 ![]() 2NO
2NO
B. 根据化学学科核心素养之一(证据推理与模型认知)可推知Cr(OH)3胶体也可吸附悬浮杂质
C. 纳米铁粉可以高效地去除污水中的重金属离子是因为其具有较强的还原性
D. 位于贵州省平塘县的中国天眼FAST使用的SiC是一种有机材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二氯化二硫(S2Cl2)为橙黄色液体,遇水易水解,工业上用于橡胶的硫化。某学习小组用氯气和硫单质合成S2Cl2的实验装置如图所示.下列说法正确的是
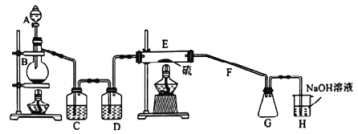
A. 实验时需先点燃E处的酒精灯
B. C、D中所盛试剂为饱和氯化钠溶液、浓硫酸
C. 二氯化二硫(S2Cl2)水解反应产物为:S、H2S、HCl
D. G中可收集到纯净的产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.使用食品添加剂以后营养更丰富
B.天然食品添加剂比化学合成品安全可靠
C.食品添加剂的作用仅仅是为了好看
D.在食品包装的标签配料表上应注明食品添加剂的名称
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知4NH3(g)+5O2(g)═4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系式为
A. 4v(NH3)=5v(O2) B. 5v(O2)=6v(H2O)
C. 2v(NH3)=3v(H2O) D. 4v(O2)=5v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的说法正确的是 ( )

A. 胆矾放在蒸发皿中灼烧可制取无水硫酸铜固体
B. 实验室蒸馏石油可用如图甲所示实验装置
C. 取用金属钠或钾时,没用完的钠或钾要放回原瓶
D. 配制500 mL 0.4 mol·L-1 NaCl溶液,必要的仪器如图乙所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同学为了验证碳和硅两种元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
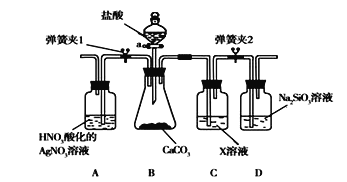
实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,关闭弹簧夹1,打开弹簧夹2当…时,关闭活塞a。
请回答:
(1)盛放盐酸的仪器名称是___________。
(2)通过步骤Ⅰ得知盐酸具有的性质是________(填字母)。
A.酸性 B.还原性 C.氧化性 D.挥发性
(3)C装置中的X是________(写化学式)。
(4)为了验证碳的非金属性强于硅,步骤Ⅱ中未写出的现象是___________________。
若通入D中的CO2足量,D中发生反应的离子方程式是______________________。
(5)碳、硅的非金属性逐渐减弱的原因是_____________________(从原子结构角度加以解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
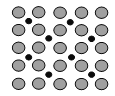
【题目】(1)诺贝尔化学奖获得者Gerhard Ertl利用光电子能谱证实:洁净铁(可用于合成氨反应的催化剂)的表面上存在氮原子,图为氮原子在铁的晶面上的单层附着局部示意图(图中小的黑色球代表氮原子,大的灰色球代表铁原子)。则在图示状况下,铁颗粒表面上N/Fe原子数比值的最大值为________________。
(2)Cu与O形成的某种化合物X,其晶胞结构如下图所示。O在顶点和体心。已知X晶胞中原子坐标参数:A为(0,0,0),B为(![]() ,
,![]() ,
,![]() ),则C原子的坐标参数为___________。
),则C原子的坐标参数为___________。

物质结构用到多种模型,请结合模型完成下列问题:

(3)D图是CaTiO3晶胞模型,同一种微粒位置相同,Ca2+位于立方体的体心,则Ti4+位于____(填顶点或面心)
(4)已知A图是CsCl晶胞模型,体心为Cs+,与其紧邻等距离的Cs+数目有___________个。
(5)某分子中原子空间位置关系如B图所示,X位于立方体的顶点,Y位于立方体中心,用X,Y表示的化学式为______________。
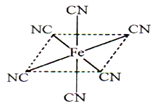
(6)铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成黄血盐,其阴离子结构如图。写出上述沉淀溶解过程的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化过程,属于吸热反应的是( )
①碳与水蒸气反应 ②将胆矾加热变为白色粉末 ③浓H2SO4稀释 ④氯化铵晶体溶于水 ⑤H2在Cl2中燃烧 ⑥液态水变成水蒸气 ⑦NH4Cl晶体与Ba(OH)28H2O混合搅拌 ⑧碳酸钙热分解.
A. ①②④⑥⑦⑧ B. ①②⑥⑦ C. ④⑥⑦⑧ D. ①②⑦⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com