
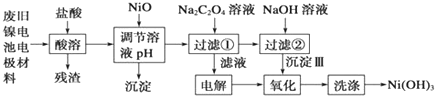
分析 将废旧镍电池电极材料溶于稀盐酸,发生反应Ni(OH)2+2HCl=NiCl2+2H2O、Fe2O3+6HCl=2FeCl3+3H2O、2Al+6HCl=2AlCl3+3H2↑,过滤得到的残渣是C,向滤液中加入NiO,条件溶液的pH,根据流程图知,生成的沉淀应该是Fe(OH)3、Al(OH)3,然后向滤液中加入Na2C2O4溶液,发生反应NiCl2+Na2C2O4=NiC2O4↓+2NaCl,过滤,将滤液电解,阳极上氯离子放电生成氯气、阴极上氢离子放电生成氢气,过滤得到的NiC2O4和NaOH反应生成Ni(OH)2,用氯气将Ni(OH)2氧化生成Ni(OH)3,最后洗涤沉淀得到较纯净的Ni(OH)3,根据铁镍蓄电池放电时总反应:Fe+Ni2O3+3H2O═Fe(OH)2+2Ni(OH)2,可判断电解液为碱性,充电时消耗氢氧根,阴极附近溶液的pH升高,据此分析解答.
解答 解:将废旧镍电池电极材料溶于稀盐酸,发生反应Ni(OH)2+2HCl=NiCl2+2H2O、Fe2O3+6HCl=2FeCl3+3H2O、2Al+6HCl=2AlCl3+3H2↑,过滤得到的残渣是C,向滤液中加入NiO,条件溶液的pH,根据流程图知,生成的沉淀应该是Fe(OH)3、Al(OH)3,然后向滤液中加入Na2C2O4溶液,发生反应NiCl2+Na2C2O4=NiC2O4↓+2NaCl,过滤,将滤液电解,阳极上氯离子放电生成氯气、阴极上氢离子放电生成氢气,过滤得到的NiC2O4和NaOH反应生成Ni(OH)2,用氯气将Ni(OH)2氧化生成Ni(OH)3,根据铁镍蓄电池放电时总反应:Fe+Ni2O3+3H2O═Fe(OH)2+2Ni(OH)2,可判断电解液为碱性,充电时消耗氢氧根,阴极附近溶液的pH升高.
(1)通过以上分析知,酸溶时能与盐酸反应的物质是Al、Ni(OH)2、Fe2O3,故答案为:碳粉;
(2)用NiO调节溶液的pH,析出沉淀的成分为Fe(OH)3、Al(OH)3,故答案为:Fe(OH)3、Al(OH)3;
(3)加入Na2C2O4溶液后反应的化学方程式为NiCl2+Na2C2O4=NiC2O4↓+2NaCl,故答案为:NiCl2+Na2C2O4=NiC2O4↓+2NaCl;
(4)加入NaOH溶液,NiC2O4沉淀转化为Ni(OH)2,NiC2O4+2OH-?Ni(OH)2+C2O42-,根据Ksp(NiC2O4)=4.0×10-10,则c(Ni2+)=c(C2O42-)=$\sqrt{Ksp}$=$\sqrt{4.0×10{\;}^{-10}}$=2×10-5mol/L;根据Ksp(Ni(OH)2):5.0×10-16,c2(OH-)=$\frac{Ksp[Ni(OH){\;}_{2}]}{c(Ni{\;}^{2+})}$=$\frac{5.0×10{\;}^{-16}}{2.0×10{\;}^{-5}}$=2.5×10-11mol2/L2;则该反应的平衡常数$\frac{C(C{\;}^{2}O{\;}_{4}{\;}^{2-})}{C{\;}^{2}(OH{\;}^{-})}$=$\frac{2×10{\;}^{-5}}{2.5×10{\;}^{-11}}$=8×105;
故答案为:NiC2O4+2OH-?Ni(OH)2+C2O42-;8×105;
(5)电解过程中阴极反应是水得电子产生氢气,电解NaCl溶液可以得到氧化性物质氯气,所以沉淀Ⅲ可被电解所得产物Cl2氧化生成Ni(OH)3,
故答案为:2H2O+2e-═H2↑+2OH-;2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-;
(6)A、根据铁镍蓄电池放电时总反应:Fe+Ni2O3+3H2O═Fe(OH)2+2Ni(OH)2,可判断电解液为碱性,故A正确;
B、充电时消耗氢氧根,阴极附近溶液的pH升高,故B错误;
C、电池放电时,负极反应为Fe+20H--2e-=Fe(OH)2,故C正确;
D、电池充电时,阳极反应为2Ni(OH)2+20H--2e-=Ni2O3+3H2O,故D正确,
故答案为:B.
点评 本题考查混合物的分离和提纯,侧重考查分析、推断、计算能力,涉及离子反应方程式的书写、平衡常数的计算、沉淀的洗涤等知识点,综合性较强,为高考高频点,明确每一步中发生的反应及物质的性质、物质分离方法即可解答,题目难度中等.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 5:3:2 | B. | 5:2:3 | C. | 5:1:2 | D. | 9:6:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
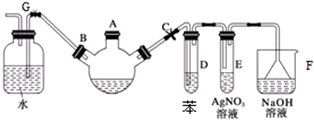
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将混合气体通过氢氧化钠溶液 | |
| B. | 使混合气体中的乙烯发生加聚反应 | |
| C. | 将混合气体在催化剂条件下跟氢气反应 | |
| D. | 将混合气体通过溴水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
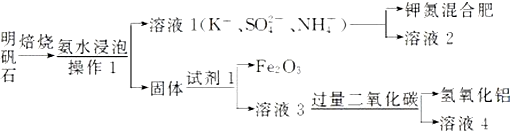
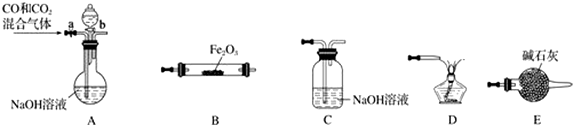
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 电极材料 | Zn | Fe | Cu | Al |
| 电极材料 | Cu | Zn | Ag | C |
| 电解质溶液 | CuCl2溶液 | H2SO4溶液 | CuSO4溶液 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com