
 .
. 分析 (1)A与CnH2n+1OH反应生成分子式为Cn+3H2n+4O2的酯,则可知A的分子式为C3H4O2,A能使溴水褪色,说明A中有碳碳不饱和键,能与碳酸钠溶液反应放出CO2,说明A中有羧基,据此可推断A的结构简式为CH2=CHCOOH;
(2)因为含碳碳双键的有机物与卤化氢发生加成反应时,氢原子总是加到含氢较多的双键碳原子上,所以B的结构简式为CH3CHBrCOOH;
(3)CH3CHBrCOOH与NaOH混合并加热,发生卤代物的碱性水解,同时发生中和反应,生成C为CH3CHOHCOONa;
(4)C为CH3CHOHCOONa,处理后得到CH3CHOHCOOH,含有羟基和羧基,可发生缩聚反应.
解答 解:(1)A与CnH2n+1OH反应生成分子式为Cn+3H2n+4O2的酯,则可知A的分子式为C3H4O2,A能使溴水褪色,说明A中有碳碳不饱和键,能与碳酸钠溶液反应放出CO2,说明A中有羧基,据此可推断A的结构简式为CH2=CHCOOH,
故答案为:C3H4O2;CH2=CHCOOH;
(2)因为含碳碳双键的有机物与卤化氢发生加成反应时,氢原子总是加到含氢较多的双键碳原子上,所以B的结构简式为CH3CHBrCOOH,
故答案为:CH3CHBrCOOH;
(3)CH3CHBrCOOH与NaOH混合并加热,发生卤代物的碱性水解,卤原子被取代成羟基,同时发生中和反应,所以生成物C的结构简式为CH3CHOHCOONa,反应的化学方程式为CH3CHBrCOOH+2NaOH→CH3CHOHCOONa+NaBr+H2O,
故答案为:CH3CHBrCOOH+2NaOH→CH3CHOHCOONa+NaBr+H2O;
(4)反应的方程式为 ,
,
故答案为: .
.
点评 本题考查有机物的推断,为高频考点,侧重于学生的分析能力的考查,题目侧重考查分子式与结构的推断、有机物性质,掌握官能团的性质与转化是关键,侧重对基础知识的巩固,难度中等.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂可以提高单位时间氨的产量 | |
| B. | 高压有利于氨的合成反应 | |
| C. | 500℃高温比室温更有利于合成氨的反应 | |
| D. | 恒温恒容下,在合成氨平衡体系中充入He,使压强增大,则平衡正向移动,NH3增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不是在室温下 | B. | 弱酸溶液与强碱溶液反应 | ||
| C. | 强酸溶液与强碱溶液反应 | D. | 二元强酸溶液和一元强碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
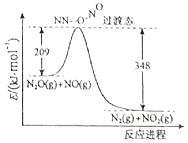 请完成下列问题
请完成下列问题| 物质 | H2(g) | Br2(g) | HBr(g) |
| 1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 向稀盐酸溶液中加入铁粉:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ | |
| D. | 向AlCl3溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ③⑤⑥ | C. | ①②④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | 丙 | |
| 容积 | 1L | 1L | 0.5L |
| 起始加入物质 | X:2mol,Y:1mol | Z:2mol | X:0.5mol,Y:0.25mol |
| 平衡时 | c(Z)=1.2mol•L-1 | c(Z)=1.2mol•L-1 |
| A. | T℃时该反应的平衡常数K为3.75 | |
| B. | 平衡时,X转化率:甲<丙 | |
| C. | 若乙是绝热容器,则平衡时,c(Z)>1.2mol•L-1 | |
| D. | 前2min内,丙容器中用X表示的平均反应速率v(X)=0.6mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com