
分析 (1)①氧化剂使Fe2+氧化为Fe3+,不能引入新杂质;
②调整溶液至pH=4,使Fe3+转化为Fe(OH)3,可加不溶于水的物质促进铁离子的水解,且不引入新杂质;
(2)由Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20可知,氢氧化铜更难溶,先生成;
(3)当两种沉淀共存时,溶液是AgCl和AgBr的饱和溶液,溶液中$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=$\frac{Ksp(AgBr)}{Ksp(AgCl)}$,以此来解答.
解答 解:(1)①氧化剂使Fe2+氧化为Fe3+,不能引入新杂质,只有过氧化氢符合,故答案为:D;
②调整溶液至pH=4,使Fe3+转化为Fe(OH)3,可加不溶于水的物质促进铁离子的水解,且不引入新杂质,而C、D均与金属阳离子反应,故答案为:AB;
(2)难溶电解质的溶度积越小,加入氨水时越易生成沉淀,则生成的沉淀为Cu(OH)2,反应的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,
故答案为:Cu(OH)2;Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;
(3)当两种沉淀共存时,溶液是AgCl和AgBr的饱和溶液,溶液中$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=$\frac{Ksp(AgBr)}{Ksp(AgCl)}$=$\frac{5.4×1{0}^{-13}}{2.0×1{0}^{-10}}$=2.7×10-3,故答案为:2.7×10-3.
点评 本题考查混合物分离提纯及难溶电解质的溶解平衡,为高频考点,把握物质的性质、性质差异及溶解平衡的计算等为解答的关键,侧重混合物分离提纯及分析与计算能力的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
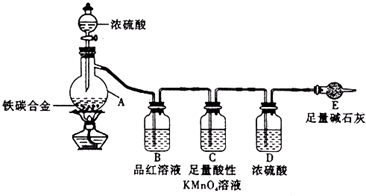
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Al条投入NaOH溶液中:Al+OH-+H2O═[Al(OH)4]-+H2↑ | |
| B. | 向氯化铵的稀溶液中加入少量NaOH NH4++OH-═NH3↑+H2O | |
| C. | 浓盐酸与铁屑反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 向浓硝酸中加入铜片Cu+4H++2N03-═Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
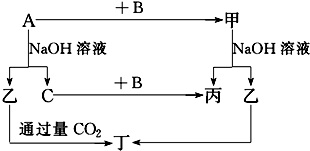
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
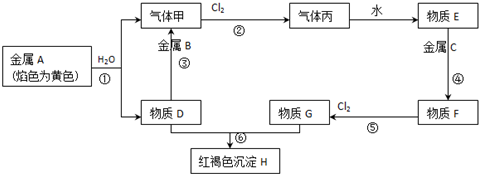
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅧA | 0 |
| 1 | ||||||||
| 2 | A | |||||||
| 3 | B | C | D | E |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铝粉投入溶液中会产生氢气:Mg2+、NO3-、K+、SO42- | |
| B. | 滴加石蕊试液会使溶液变蓝:Na+、Al3+、CO32-、NO3- | |
| C. | 将锌粒投入溶液中会产生氢气:Ca2+、Cl-、Mg2+、NH4+ | |
| D. | 溶液能使淀粉碘化钾试纸变蓝NH4+、CO32-、Cl-、SO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com