

| A. | 阴极反应可表示为 2H++VO2++e-═V3++H2O | |
| B. | 阳极反应可表示为 V2+-e-═V3+ | |
| C. | 若阴极电解液体积为1L,电解前pH=1,当测得V3+的物质的量浓度为0.045mol/L时,pH变为2(不考虑反应过程中体积变化) | |
| D. | 放电过程种负极反应可表示为V3++2OH--e-═VO2++H2O |
分析 由总反应可知,充电时,阳极发生氧化反应,V2+被氧化生成V3+,电极方程式为V2+-e-═V3+,阴极发生还原反应,VO2+被还原生成V3+,电极方程式为2H++VO2++e-═V3++H2O,以此解答该题.
解答 解:A.阴极发生还原反应,VO2+被还原生成V3+,电极方程式为2H++VO2++e-═V3++H2O,故A正确;
B.阳极发生氧化反应,V2+被氧化生成V3+,电极方程式为V2+-e-═V3+,故B正确;
C.阴极发生2H++VO2++e-═V3++H2O,当测得V3+的物质的量浓度为0.045mol/L时,消耗0.09molH+,则剩余c(H+)=$\frac{0.1mol-0.09mol}{1L}$=0.01mol/L,pH=2,故C正确;
D.电解质溶液呈酸性,放电过程种负极发生V3++H2O-e-=2H++VO2+,故D错误.
故选D.
点评 本题考查原电池的工作原理,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意把握原电池中电子及溶液中离子的定向移动问题,本题从化合价的变化进行判断是做题的关键.


科目:高中化学 来源: 题型:解答题
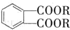 (代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示: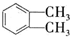 $→_{①光照}^{Cl_{2}}$[A]$\stackrel{②}{→}$[B]$→_{③△}^{Cu、O_{2}}$[C]$\stackrel{④}{→}$[D]$→_{⑤ROH/△}^{浓硫酸}$[DMP]
$→_{①光照}^{Cl_{2}}$[A]$\stackrel{②}{→}$[B]$→_{③△}^{Cu、O_{2}}$[C]$\stackrel{④}{→}$[D]$→_{⑤ROH/△}^{浓硫酸}$[DMP]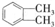 的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基,DMP的分子式为C10H10O4.
的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基,DMP的分子式为C10H10O4.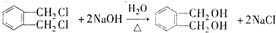 .
. .
.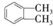 制备DMP的另一种途径:
制备DMP的另一种途径: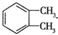 $→_{O_{2}①}^{催化剂、△}$
$→_{O_{2}①}^{催化剂、△}$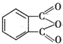 $→_{F②}^{适当条件}$[DMP]
$→_{F②}^{适当条件}$[DMP]查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑦ | B. | ①②③④ | C. | ①③④⑤ | D. | ①④⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
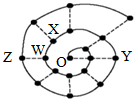 某同学在研究前18号元素时发现,可以将它们排成如下图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点(最中心的点)代表起点元素.下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如下图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点(最中心的点)代表起点元素.下列说法中正确的是( )| A. | 物质YO可能具有较强的氧化性 | |
| B. | 图中离O点越远的元素,其原子半径一定越大 | |
| C. | O2X、WO3分子内都含有氢键,所以沸点都较高 | |
| D. | 科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的Z元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
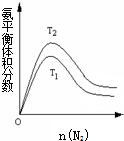 合成氨工业对国民经济和社会发展具有重要的意义.其原理为:
合成氨工业对国民经济和社会发展具有重要的意义.其原理为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7的溶液中:K+、Na+、Fe3+、SO42- | |
| B. | 饱和NaHCO3溶液中:Al3+、NO3-、I-、Cl- | |
| C. | 水电离产生的c(H+)=10-13 mol•L-1的溶液中:Na+、I-、NO3-、HCO3- | |
| D. | 0.1 mol•L-1FeSO4溶液中:K+、Zn2+、Br-、I- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com