
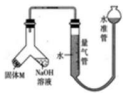
 某课外兴趣小组为探究某种铝合金(合金元素为 Mg、Al)是否符合国家质量标准(国 家规定其中铝含量不能低于 78%),设计如图所示装置进行实验.
某课外兴趣小组为探究某种铝合金(合金元素为 Mg、Al)是否符合国家质量标准(国 家规定其中铝含量不能低于 78%),设计如图所示装置进行实验.分析 (1)检验装置的气密性常用方法为利用气体的热胀冷缩或液封气体形成液面高度差,由装置图可知适合选择液封气体形成液面高度差,一定时间,液面高度差保持不变,说明气密性良好;
(2)铝与氢氧化钠、水反应生成偏铝酸钠、氢气;
(3)量气管最大量程为50mL,则产生氢气的增大体积为50mL,计算氢气的最大物质的量,根据电子转移守恒可知3n(Al)=2n(H2),据此计算铝的最大质量;
(4)读数前,应保持量气管和水准管液面相平,保证压强相等;
(5)根据氢气的体积V=44.8mL计算氢气的物质的量,根据电子转移守恒可知3n(Al)=2n(H2),据此计算铝的质量,再计算Al的质量分数;
(6)Mg、Al都与盐酸反应生成氢气,改用盐酸生成气体体积增大,据此判断.
解答 解:(1)检验装置的气密性常用方法为利用气体的热胀冷缩或液封气体形成液面高度差,由装置图可知适合选择液封气体形成液面高度差,检验该装置气密性的方法为:安装好装置并在量气管内加人水,向下移动水准管,静置片刻,若水准管中液面与量气管液面维持一定的高度差,说明装置密封,
故答案为:安装好装置并在量气管内加入水,向下移动水准管,静置片刻,若水准管中液面与量气管液面维持一定的高度差,说明装置密封;
(2)铝与氢氧化钠、水反应生成偏铝酸钠、氢气,反应离子方程式为2OH-+2Al+2H2O═2AlO2-+3H2↑,
故答案为:2OH-+2Al+2H2O═2AlO2-+3H2↑;
(3)量气管最大量程为50mL,则产生氢气的体积为50mL,所以氢气的最大物质的量为$\frac{0.05L}{22.4L/mol}$=$\frac{0.05}{22.4}$mol,根据电子转移守恒可知3n(Al)=2n(H2)=$\frac{0.05}{22.4}$mol×2,故铝的最大质量为$\frac{1}{3}$×$\frac{0.05}{22.4}$mol×2×27g/mol=0.04g,所以金属铝的质量范围为0<mAl<0.04g,
故答案为:0<mAl<0.04g;
(4)为了准确地测量氢气的体积,在读取量气管中液面读数的过程中,应注意:①读数时 视线与凹液面最低处相平,②调节量气管和水准管液面相平,
故答案为:调节量气管和水准管液面相平;
(5)44.8mL氢气的物质的量为$\frac{0.0448L}{22.4L/mol}$=0.002mol,根据电子转移守恒可知3n(Al)=2n(H2)=0.002mol×2=0.004mol,所以合金中铝的质量$\frac{1}{3}$×0.004mol×27g/mol=0.036g,合金中Al的质量分数为$\frac{0.036g}{0.038g}$×100%=94.7%,
故答案为:94.7%;
(5)Mg、Al都与盐酸反应生成氢气,改用盐酸生成氢气的体积增大,
故答案为:>.
点评 本题考查学生对实验原理与实验装置的理解、元素化合物性质、物质组成测定、化学计算等,难度中等,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
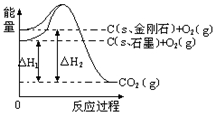
| A. | 石墨和金刚石互为同位素 | |
| B. | 金刚石的总能量比石墨的总能量高1.9 kJ | |
| C. | C(石墨)═C(金刚石)△H=+1.9 kJ•mol-1 | |
| D. | C(s,石墨)═C(s,金刚石)△H=+1.9 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com