
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ④ |
分析 ①碳酸酸性弱于盐酸,向CaCl2溶液中通入过量CO2,无现象;
②向澄清石灰水中缓慢通入过量的SO2,先生成亚硫酸钙沉淀,然后亚硫酸钙与二氧化硫、水反应生成亚硫酸氢钙;
③向Fe(OH)3胶体中逐滴加入过量的稀硫酸,先胶体和电解质溶液产生聚沉现象,有沉淀生成;后氢氧化铁又和硫酸反应生成可溶性的硫酸铁;
④反应生成氢氧化铁沉淀.
解答 解:①盐酸是强酸,碳酸是弱酸,所以碳酸不能制取盐酸,即二氧化碳和氯化钙不反应,最终没有沉淀析出,故①错误;
②向澄清石灰水中缓慢通入过量的SO2,先生成亚硫酸钙沉淀,然后亚硫酸钙与二氧化硫、水反应生成亚硫酸氢钙,白色沉淀溶解,故②正确;
③向Fe(OH)3胶体中逐滴加入过量的稀硫酸,先胶体和电解质溶液产生聚沉现象,有沉淀生成;后氢氧化铁又和硫酸反应生成可溶性的硫酸铁,所以沉淀又溶解,故③正确;
④反应生成氢氧化铁沉淀,氢氧化铁沉淀与氢氧化钠不反应,故④错误.
故选C.
点评 本题考查较为综合,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,题目难度中等,解答本题的关键是把握物质的性质,注意有的物质之间发生反应时滴加顺序不同反应不同.


科目:高中化学 来源: 题型:选择题
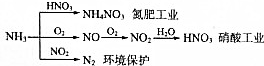
| A. | NH4NO3是常用化肥,在农业上用作棉花、亚麻、大麻、烟草和蔬菜等农作物的肥料,效果特别好 | |
| B. | 硝酸工业中氮元素的化合价变化情况:-3→+2→+4→+5 | |
| C. | NH3和NO2在一定条件下发生氧化还原反应,其化学方程式:8NH3+6NO2$\frac{\underline{催化剂}}{△}$7N2+12H20 | |
| D. | NH3在氮肥工业中氮元素被还原,而在硝酸工业中氮元素被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验事实 | 结论 | |
| A | 加碱加热产生使湿润红色石蕊试纸变蓝的气体 | 溶液中含有NH4+ |
| B | 加BaCl2溶液有白色沉淀,加稀硝酸沉淀不溶解 | 该溶液中一定含有SO42- |
| C | 加KSCN溶液无现象•再滴加氯水变血红 | 溶液中有Fe2+ |
| D | 加热时.铜能与浓硫酸反应 | 浓硫酸有强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、Cl-、ClO- | B. | K+、NO3-、Cl-、CO32- | ||
| C. | NH4+、Ca2+、OH-、HCO3- | D. | Al3+、NO3-、SO42-、MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
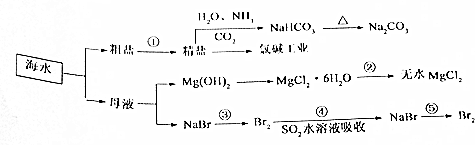
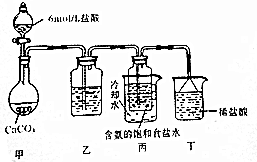
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应的实质是旧化学键断裂和新化学键的形成 | |
| B. | 物质由高能量向低能量转化时,放出热量 | |
| C. | 将一定质量的C燃烧,生成CO2时比生成CO时放出的热量多 | |
| D. | 干冰升华时放出大量的热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Fe2+ | Fe3+ | Mn2+ | Ni2+ | Co2+ | |
| 氢氧化物沉淀 | 开始沉淀的PH | 7.5 | 2.2 | 8.8 | 6.4 | 9.0 |
| 完全沉淀的PH | 9.5 | 3.5 | 10.8 | 8.4 | ||
| 硫化物沉淀 | 开始沉淀的PH | 6.2 | 4.67 | |||
| 完全沉淀的PH | ||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com