


科目:高中化学 来源: 题型:阅读理解
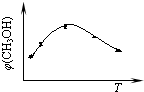
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)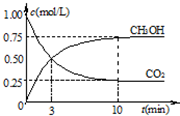 随时间变化如图所示.下列说法正确的是
随时间变化如图所示.下列说法正确的是 CH3OH(g)+H2O(g)达到平衡状态的是
CH3OH(g)+H2O(g)达到平衡状态的是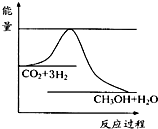
 CH3OH(g)+H2O(g)进行过程中能量(单位为kJ?mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,达到平衡后,采取下列措施中能使c(CH3OH)增大的是
CH3OH(g)+H2O(g)进行过程中能量(单位为kJ?mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,达到平衡后,采取下列措施中能使c(CH3OH)增大的是
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 16 |
| 3 |
| 16 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
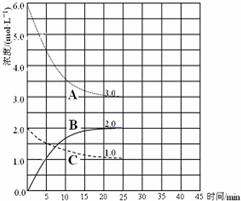 合成氨对农业生产及国防建设均具有重要意义.已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ?mol-1如图是在恒温恒容密闭容器中进行合成氨反应的图象
合成氨对农业生产及国防建设均具有重要意义.已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ?mol-1如图是在恒温恒容密闭容器中进行合成氨反应的图象| A、前25min内,用H2浓度变化表示的化学反应平均速率是0.04 mol?L-1?min-1 | B、在25min 末反应刚好达到平衡,则该温度下反应的平衡常数K=0.148 | C、该反应达到平衡时放出热量为92kJ | D、V正(N2)=2V逆(NH3)说明到达平衡状态 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省庆安三中高二上学期期中考试化学试卷(带解析) 题型:单选题
对恒温恒容密闭容器中的可逆反应:A(g)+3B(g)  2C(g) ?H <0,下列叙述错误的是
2C(g) ?H <0,下列叙述错误的是
| A.升高温度v(正)、v(逆)都增大,但v(逆)增的更大 |
| B.增大压强v(正)、v(逆)都增大,但v(正)增的更大 |
| C.增大A的浓度v(正)会增大,但v(逆)会减小 |
| D.采用正的催化剂一般v(正)、v(逆)同时增大,而且增大的倍数相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com