
氮元素广泛存在于自然界中,对人类生命和生活具有重要意义。含氮元素的化合物在工业生产和国防建设中都有广泛的应用。
(1)氮元素原子核外有 个未成对电子,最外层有 种能量不同的电子。PH3分子的空间构型为 ,是 分子。(填极性或非极性)
(2)氮和磷是同主族元素,下列能说明二者非金属性相对强弱的是 (填编号)
a.NH3比PH3稳定性强
b.硝酸显强氧化性,磷酸不显强氧化性
c.氮气与氢气能直接化合,磷与氢气很难直接化合
d.氮气常温是气体,磷单质是固体
亚硝酸盐是食品添加剂中急性毒性较强的物质之一,可使正常的血红蛋白变成正铁血红蛋白而失去携带氧的功能,导致组织缺氧。
(3)亚硝酸钠溶液滴加到K2Cr2O7酸性溶液中,溶液由橙色变为绿色,反应如下,补上缺项物质并配平:
Cr2O72- + NO2- + → Cr3+ + NO3-+
(4)上题反应中每消耗0.6mol NO2-,转移电子数为 。
(5)氮氧化物(NO和NO2)污染环境。若用Na2CO3溶液吸收NO2可生成CO2,9.2gNO2和Na2CO3溶液完全反应时转移电子0.1 mol,则反应的离子方程式为 。
(1)3 2 三角锥形 极性
(2)a c
(3)Cr2O72- + 3NO2- + 8H+ →2Cr3+ + 3NO3- + 4H2O
(4)1.2NA
(5)2NO2+CO32-→ NO2-+NO3-+CO2
【解析】
试题分析:(1)氮元素的原子序数是7,其核外电子排布为1s22s22p3,原子核外有3个未成对电子,最外层有2种能量不同的电子。PH3分子中P原子含有1对孤对电子,价电子数是4,所以其空间构型为三角锥形,是极性分子。
(2)a.非金属性越强,氢化物的稳定性越强,因此NH3比PH3稳定性强可以说明二者非金属性相对强弱,a正确;b.硝酸显强氧化性,磷酸不显强氧化性与非金属性强弱无关系,b不正确;c.非金属性越强,越容易与氢气化合,因此氮气与氢气能直接化合,磷与氢气很难直接化合可以说明二者非金属性相对强弱,c正确;d.氮气常温是气体,磷单质是固体,非金属性强弱与状态无关系,d不正确,答案选ac。
(3)根据方程式可知Cr元素的化合价从+6价降低到+3价,得到3个电子。氮元素的化合价从+3价升高到+5价,失去2个电子,所以根据电子得失守恒可知配平后的方程式为Cr2O72- + 3NO2- + 8H+ →2Cr3+ + 3NO3- + 4H2O。
(4)氮元素的化合价从+3价升高到+5价,失去2个电子,所以每消耗0.6mol NO2-,转移电子数为0.6×2×NA=1.2NA。
(5)9.2gNO2的物质的量是9.2g÷46g/mol=0.2mol,反应中转移0.1mol电子,所以在反应中NO2部分不还原为亚硝酸根,另外一部分转化为硝酸根,所以反应的离子方程式为2NO2+CO32-→ NO2-+NO3-+CO2。
考点:考查核外电子排布、非金属性强弱比较以及氧化还原反应的有关应用与计算


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014学年天津市高三年级4月考理综化学试卷(解析版) 题型:填空题
化学反应原理对于工业生产和科研有重要意义
I、下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
化学反应 | 平衡常数 | 温度 | |
973 K | 1173 K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g) +H2O(g) | K3 | ? | ? |
请回答:
(1)反应①是 (填“吸热”或“放热”)反应。
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=__________(用K1、K2表示)。
(3)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有 _____(填写字母序号)。
A.缩小反应容器的容积
B.扩大反应容器的容积
C.升高温度
D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(4)若反应③的逆反应速率与时间的关系如图所示:
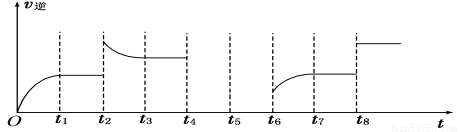
①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时__________________; t8时__________________。
②若t4时降压, t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
II、(5)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该装置的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应为 。
(6)某空间站能量转化系统的局部如图所示,其中的燃料电池采用KOH溶液作电解液。
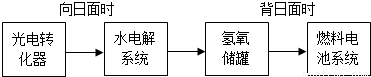
如果某段时间内,氢氧储罐中共收集到33.6L气体(已折算成标准状况),则该段时间内水电解系统中转移电子的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市通州区高三年级模拟考试(一)理综化学试卷(解析版) 题型:选择题
下列说法中,正确的是
A.糖类、油脂和蛋白质都是人体所需要的营养素
B.节日焰火的五彩缤纷是某些金属单质性质的体现
C.化学反应能够制造出新的物质,同时也能制造出新的元素
D.为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市丰台区高三下学期统一练习(一)化学试卷(解析版) 题型:选择题
用如图所示装置进行实验,实验现象正确的是
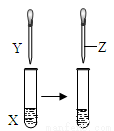
| X | Y | Z | 实验现象 |
A | 苯酚浑浊液 | NaOH溶液 | 盐酸 | 浑浊液变澄清,后又变浑浊 |
B | FeCl3溶液 | KSCN溶液 | 饱和KCl溶液 | 溶液变为红色,后颜色加深 |
C | KI溶液 | 足量氯水 | 乙醇
| 溶液变为黄色,后溶液分层,上层为紫红色,下层为无色 |
D | Na2SO3溶液 | Ba(NO3)2溶液 | 盐酸 | 生成白色沉淀,后沉淀溶解,有大量气体生成 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:填空题
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化为烃B、烃C。以C为原料可以合成聚对羟基苯甲酸 (G)。已知:
①A是一种有机酸,分子式为C9H10O3。
②B的相对分子质量为104,分子中含苯环且能使溴的四氯化碳溶液褪色。
③C的相对分子质量为78,且分子中只有一种氢原子。
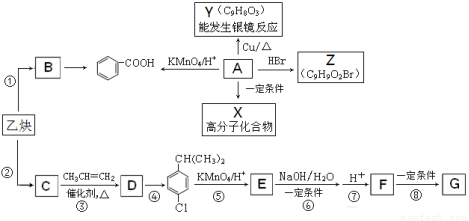
(1)写出乙炔分子的电子式 , F中的含氧官能团名称 ;
(2)上述①至⑧的反应中,属于加成反应的有 ,第④步反应所需的试剂和条件是 ;
(3)写出A的结构简式 ;
(4)下列有关的描述中,正确的是 ;
a. 1molB最多能与4molH2加成
b. B通过氧化反应可使溴水和酸性KMnO4溶液褪色
c. B、C、D是同系物
d. A→X的反应属于缩聚反应
(5)写出F→G反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:选择题
下列说法中,正确的是
A.在纸上层析操作时,要让试样点刚好接触展开剂,否则不能很好地分离。
B.实验室制备硝基苯时,先将浓硫酸滴入浓硝酸后,冷却,再边振荡边滴加苯。
C.从海带中提取碘的方法是:取样→灼烧→溶解→过滤→萃取。
D.向盛有少量Na2O2的试管中加入少量水,并立即滴入2滴酚酞,振荡,溶液呈红色。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇、松江、金山三区高三二模化学试卷(解析版) 题型:填空题
液化石油气中常存在少量有毒气体羰基硫(COS),必须将其脱除以减少环境污染和设备腐蚀。完成下列填空。
(1)写出羰基硫的电子式 ,羰基硫分子属于 (选填“极性”、“非极性”)分子。
(2)下列能说明碳与硫两元素非金属性相对强弱的是 。
a.相同条件下水溶液的pH:Na2CO3>Na2SO4
b.酸性:H2SO3>H2CO3
c.CS2中碳元素为+4价,硫元素为-2价
(3)羰基硫在水存在时会缓慢水解生成H2S,对钢铁设备产生电化学腐蚀。写出正极的电极反应式 ,负极的反应产物为 (填化学式)。
为除去羰基硫,工业上常采用催化加氢转化法,把羰基硫转化为H2S再除去:COS + H2  CO + H2S
CO + H2S
(4)已知升高温度,会降低羰基硫的转化率。则升高温度,平衡常数K ,反应速率 (均选填“增大”、“减小”、“不变”)。
(5)若反应在恒容绝热密闭容器中进行,能说明该反应已达到平衡状态的是 。
a.容器内气体密度保持不变 b.容器内温度保持不变
c.c(H2)=c(H2S) d.υ(H2)正=υ(H2S)正
(6)已知该反应的平衡常数很大,说明 。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:选择题
除去乙烷中乙烯的办法是
A.通过酸性高锰酸钾溶液 B.通过溴水 C.通过浓硫酸 D.通过石灰水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com