
已知反应A+B= C+D的能量变化如下图所示,下列说法正确的是
| A.该反应是放热反应 |
| B.只有在加热条件下才能进行 |
| C.反应物的总能量高于生成物的总能量 |
| D.反应中断开化学键吸收的总能量高于形成化学键放出的总能量 |
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:单选题
下列关于热化学反应的描述中正确的是
| A.HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3) kJ/mol |
| B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+566.0 kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.Ba(OH)2·8H2O与NH4Cl反应的焓变小于0,所以在常温下能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
A.右图可表示水分解过程中的能量变化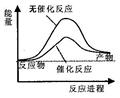 |
| B.若2C(s)+O2(g)=2CO(g)△H=" -221.0" kJ/mol,则碳的燃烧热为110.5 kJ/mol |
| C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 |
| D.已知:Ⅰ:对于反应:H2(g)+Cl2(s)="2HCl" (g)△H=" -" a kJ/mol, |

查看答案和解析>>
科目:高中化学 来源: 题型:单选题
反应A(g)+B(g) C(g) +D(g)过程中的能量变化如图所示,下列说法正确的是
C(g) +D(g)过程中的能量变化如图所示,下列说法正确的是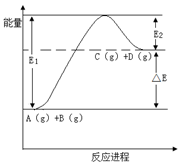
| A.该反应是放热反应 |
| B.加入催化剂后,反应加快,△E减小 |
| C.反应物的总键能大于生成物的总键能 |
| D.反应达到平衡时,升高温度,A的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
参照反应Br + H2 HBr +H的能量对反应历程的示意图,下列对上述正反应叙述中正确的
HBr +H的能量对反应历程的示意图,下列对上述正反应叙述中正确的 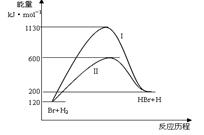
| A.反应热:过程I>过程Ⅱ |
| B.反应速率:过程Ⅱ=过程I |
| C.该反应为吸热反应 |
| D.过程I使用了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法中,正确的是 ( )
| A.室温下,pH=5.6的NaHSO3溶液中c( SO32-)-c( H2SO3)= 10-5.6-10-8.4 |
| B.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
| C.吸热反应只有在加热条件下才能发生,故水不加热不电离 |
| D.过量的氨水和盐酸反应所得溶液不可能为酸性,但可能为中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
关于热化学方程式:2H2(g)+02(g)=2H20(1)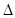 H=-571.6 kJ·mol-1,下列关叙述不正确的是 ( )
H=-571.6 kJ·mol-1,下列关叙述不正确的是 ( )
| A.2mol H2完全燃烧生成液态水放出571.6 kJ的热 |
| B.1mol H2完全燃烧生成液态水时放出285.8kJ的热 |
| C.2个氢分子完全燃烧生成液态水时放出571.6 kJ的热 |
D.上述热化学方程式可表示为H2(g)+1/2 O2(g)=H20(1),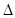 H=-285.8 kJ·mol-1 H=-285.8 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法中不正确的是
| A.与煤油、柴油相比较,天然气是一种比较清洁的化石燃料 |
| B.乙醇是一种可再生能源,作为燃料的优点的是完全燃烧的产物不污染环境 |
| C.利用太阳能、风能和氢能等能源替代化石能源能有效改善空气质量 |
| D.煤的气化和液化不仅可以获得洁净燃料,而且再燃烧会放出更多的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1
请回答下列问题:
(1)图中A、C分别表示_________、_________,E的大小对该反应 的反应热有无影响?_________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_________,理由是__________________;(2)图中ΔH=_________kJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒氧化物VO2;四价钒氧化物再被氧气氧化。写出该催化循环机理的化学方程式_____________________________;
(4)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3mol SO3(g)的ΔH_______(要求计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com