
【题目】下列离子方程式书写正确的是
A.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4![]() +2H2O
+2H2O
B.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
C.实验室用氯化铵和熟石灰制氨:![]() +OH-
+OH-![]() NH3↑+H2O
NH3↑+H2O
D.Cu与足量的浓硝酸:Cu+2![]() +4H+=Cu2++2NO2↑+2H2O
+4H+=Cu2++2NO2↑+2H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有 NaCl、Na2SO4 和 NaNO3 的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3 晶体,相应的实验流程如图所示。
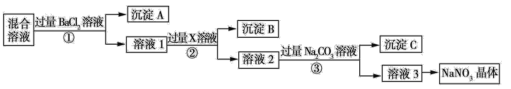
(1)写出实验流程中下列物质的化学式:试剂 X___________,沉淀 A_________。
(2)上述实验流程中①②③步均要进行的实验操作是______________(填操作名称),该过程中玻璃棒的作用是___________。
(3)上述实验流程中加入过量 Na2CO3 溶液的目的是_____________。
(4)按此实验方案得到的溶液3中肯定含有_________________(填化学式)杂质。为了解决这个问题,可以向溶液3中加入适量的_________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Si金属间化合物是近几年研究的热点材料,它在电子学、热电、光电和磁学等领域有着广泛的应用,另外铁的配合物也有极其广泛的用途。回答下列问题:
(1)铁的一种配合物的化学式为[Fe(Htrz)3](ClO4)2,其中Htrz为1,2,4–三氮唑(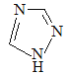 )。
)。
①配合物中阴离子空间构型为________,中心原子的杂化方式是________。
②Htrz分子中含σ键数为______个,其与Fe2+形成配位键的原子是_______。
③1,2,4–三氮唑与环戊二烯(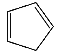 )的物理性质如下:
)的物理性质如下:
环戊二烯 | 1,2,4–三氮唑 | |
相对分子质量 | 66 | 69 |
物理性质 | 无色液体,不溶于水,沸点为42.5℃ | 无色晶体,溶于水,沸点为260℃ |
它们的水溶性和沸点差异很大的主要原因是________________________。
(2)一种Fe、Si金属间化合物的晶胞结构如下图所示:

晶胞中含铁原子为_____个,已知晶胞参数为0.564nm,阿伏加德罗常数的值为NA,则Fe、Si金属间化合物的密度为___________g·cm–3(列出计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用![]() 溶液滴定
溶液滴定![]() 溶液,曲线如图所示。下列说法错误的是
溶液,曲线如图所示。下列说法错误的是
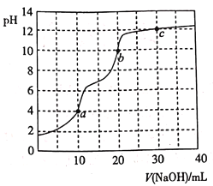
A.滴定终点a可选择甲基橙作指示剂
B.c点溶液中![]()
C.b点溶液中![]()
D.a、b、c三点中水的电离程度最大的是c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扑炎痛是一种新型解热镇痛抗炎药,其结构简式如图: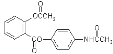 ,下列关于扑炎痛的叙述错误的是( )
,下列关于扑炎痛的叙述错误的是( )
A. 该物质的相对分子质量为313B. 该物质的水解产物有氨基酸
C. 该物质的水解产物之一与甲酸甲酯互为同分异构体D. 该物质的核磁共振氢谱上共有9个峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如下装置制备氯酸钾和次氯酸钠。
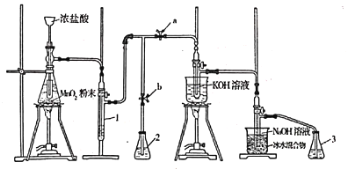
回答下列问题:
(1)滴加浓盐酸的漏斗伸入试管底部,其原因为________________________________。
(2)装置1中盛放的试剂为________;若取消此装置,对实验造成的影响为________。
(3)装置中生成氯酸钾的化学方程式为________________________,产生等物质的量的氯酸钾和次氯酸钠,转移电子的物质的量之比为________。
(4)装置2和3中盛放的试剂均为________。
(5)待生成氯酸钾和次氯酸钠的反应结束后,停止加热。接下来的操作为打开________(填“a”或“b”,下同),关闭________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为中学化学中的一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的最高价氧化物是耐火材料;H为气体单质,D为无色气体,在空气中会出现红棕色。各物质的转化关系如图(部分反应产物已略去)。
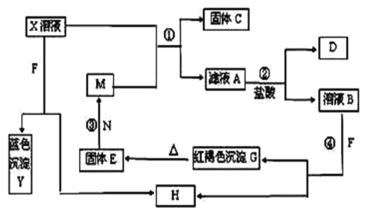
请回答下列问题:
(1)固体E的化学式为___________,写出H的化学式为___________
(2)在反应①②③④中属于置换反应的是___________(填序号)。
(3)反应②的离子方程式为___________________________。
(4)X溶液与F反应的总化学方程式为___________。
(5)若向100mL盐X的溶液中加入10g金属单质M的粉末,充分搅拌后,过滤,烘干得10.16g固体C。则滤液A中溶质的物质的量浓度为_____________。(假设溶液体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用Fe2(SO4)3溶液吸收含SO2的尾气(SO2的体积分数约10%,其余为空气),实验装置如图所示:
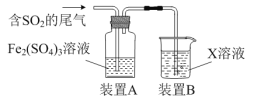
(1)装置A中SO2与Fe2(SO4)3溶液中反应生成FeSO4,写出该反应的化学方程式:___。
(2)反应后,若要检验装置A中Fe3+是否过量,可用试剂为___;若要检验SO2是否过量,可用试剂为___。
(3)装置B中所用X溶液为___,作用是___。
(4)若实验测得反应后的装置A中不含有SO2,为测定其中所含FeSO4的物质的量浓度,现进行如下实验:取20.00mL装置A中溶液,向其中逐滴加入0.1000mol·L-1Ce(SO4)2溶液,发生反应Fe2++Ce4+=Ce3++Fe3+,当反应恰好完全时,共消耗Ce(SO4)2溶液18.00mL。请通过计算确定FeSO4的物质的量浓度___(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素在周期表中的位置如图,Y的氧化物随意排放易形成酸雨,下列说法不正确的是:
![]()
A.化合物XZ3分子中只存在极性共价键
B.X、Y、Z三种元素分别形成的含氧酸不一定都是强酸
C.因为非金属性Z>Y,所以水溶液中酸性HZ>H2Y
D.X的最高价氧化物对应的水化物和X的简单氢化物能形成盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com