
科目:高中化学 来源:2015-2016学年浙江省高二上期中测试化学试卷(解析版) 题型:实验题
【加试题】乳酸亚铁([CH3CH(OH)COO]2Fe·3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe·3H2O+CO2↑。
已知FeCO3易被氧化:4FeCO3+6H2O+O2=4Fe(OH)3+4CO2。
某兴趣小组用FeCl2(用铁粉和稀盐酸制得)和NH4HCO3制备FeCO3的装置示意图如下:

回答下列问题:
(1)NH4HCO3盛放在装置 中(填字母),该装置中涉及的主要反应的离子方程式 。
(2)将生成的FeCl2溶液和NH4HCO3溶液混合时的操作是 。
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75℃下搅拌反应。反应结束后,无需过滤,除去过量铁粉的方法是 。
(4)该兴趣小组用KMnO4法测定样品中亚铁含量进而计算产品中乳酸亚铁的质量分数,发现产品的质量分数总是大于100%,其原因可能是 。
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期12月质检化学试卷(解析版) 题型:选择题
常温下,浓度均为0.1 mol•L-1的4种钠盐溶液pH如下:
溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
pH | 11.6 | 9.7 | 10.3 | 5.2 |
下列说法中不正确的是
A.四种溶液中,Na2CO3溶液中水的电离程度最大
B.向氯水中加入NaHCO3(s),可以增大氯水中次氯酸的浓度
C.NaHSO3溶液显酸性的原因是:NaHSO3=Na++H++SO32-
D.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最小的是H2SO3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东汕头金山中学高二上10月月考化学卷(解析版) 题型:填空题
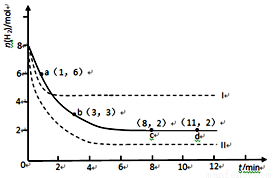
固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
(1)a点正反应速率___________(填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是__________,最小的是______。
A.0~1min B.1~3min
C.3~8min D.8~11min
(3)求平衡时氢气的转化率和该条件下反应的平衡常数K。(写出计算过程)
(4)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是___________,曲线II对应的实验条件改变是___________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东汕头金山中学高一上12月月考化学卷(解析版) 题型:选择题
将m g的某种可燃物A在过量的氧气中充分燃烧,再将燃烧的产物通过足量Na2O2充分地吸收,发现固体增加的质量大于m g。则可燃物A可能是
A.一氧化碳 B.乙醇(C2H5OH) C.甲酸(HCOOH) D.甲醇(CH3OH)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上二调考试化学试卷(解析版) 题型:选择题
相同条件下,现有四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。下列有关说法正确的是( )
A.由水电离出的c(H+):①=②=③=④
B.将②、③溶液混合后,pH=7,消耗溶液的体积:③=②
C.等体积的①、②、④溶液分别与足量铝粉反应,②生成的H2的物质的量最大
D.向溶液中加入100mL水后,溶液的pH:③>④>①>②
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上期中(理)化学试卷(解析版) 题型:填空题
CO和NO对环境影响较大,属于当今社会热点问题。请回答下列问题
(1)降低汽车尾气的反应:2NO(g)+2CO(g) N2(g)+2CO2(g)若NO中的键能是632kJ/mol,CO中的键能是1072 kJ/mol,CO2中C=O的键的键能为750 kJ/mol,N2中的键能是946kJ/mol,则该反应的△H=___________
N2(g)+2CO2(g)若NO中的键能是632kJ/mol,CO中的键能是1072 kJ/mol,CO2中C=O的键的键能为750 kJ/mol,N2中的键能是946kJ/mol,则该反应的△H=___________
(2)若在一定温度下,将1.4molNO、1.2molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示

①该反应的平衡常数K=___________
②若保持温度不变,20min时再向容器中冲入CO、N2各0.8mol,平衡将向_______移动(填“向左”“向右”或“不”)
③20min时,若改变反应条件,导致CO浓度发生如图所示的变化,则改变的条件可能 是_______(填序号)
a.缩小容器体积 b.增加CO2的量 c.升高温度 d.加入催化剂
(3)固氮是科学家致力研究的重要课题,自然界中存在天然的大气固氮过程:N2(g)+O2(g)→2NO (g)-180.8kJ,工业合成氨则是人工固氮.
分析两种固氮反应的平衡常数,下列结论正确的是______________。
反应 | 大气固氮 | 工业固氮 | ||||
温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
A.常温下,大气固氮很难进行,而工业固氮却能非常容易进行
B.K越大说明合成氨反应的速率越大
C.工业固氮时温度越低,氮气与氢气反应越完全
D.模拟大气固氮应用于工业上的意义不大
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期期中考试化学试卷(解析版) 题型:推断题
随原子序数的递增,八种短周期元素(用字母X等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)z在元素周期表的位置是 。
(2)比较d、f简单离子的半径大小(用化学符号表示,下同) > ;
比较d、g元素的简单气态氢化物的稳定性大小 > 。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式 。
(4)已知1mol固体e的单质在足量d2气体中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式 。
(5)由上述元素组成的离子化合物 Q:eh 和 W:e2gd4,若电解含2 molQ和2 molW的混合水溶液,当阳极产生44.8L气体(标准状况下,且不考虑气体的溶解和损失)时,电路中转移电子的物质的量为 mol。
(6)上述元素可组成盐R:zx4f(gd4)2。向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1 NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:

①R溶液中,离子浓度由大到小的顺序是 。
②写出m点发生反应的离子方程式 。
③若在R溶液中改加20mL 1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上第四次段考化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值,下列说法正确的是
A.1 mol Na2O2与SO2完全反应时转移电子数为NA
B.18g重水(D2O)所含的电子数为10NA
C.0. 5 mol NH4HSO4晶体中,含有H+数目约为0.5 NA
D.常温常压下,3gHCHO和CH3COOH的混合物中含有0.4NA个原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com