
 =1×10-8,下列叙述正确的是( )
=1×10-8,下列叙述正确的是( ) 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源:不详 题型:填空题
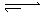 mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间(s) c(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(A) | 0.20 | 0.14 | b | 0.09 | 0.09 | 0.09 |
| c(B) | 0.00 | 0.12 | 0.20 | c | d | e |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
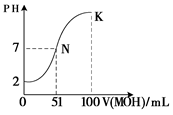
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
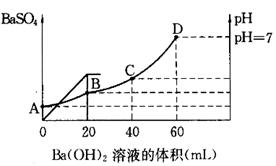
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.01 mol·L-1 | B.0.017 mol·L-1 | C.0.05 mol·L-1 | D.0.50 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.29 | B.29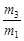 | C.29 | D.29 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.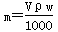 | B.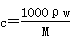 | C.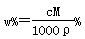 | D.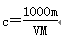 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.2H2(g)+O2(g) = 2H2O(1)△H= ―285.8kJ/mol |
| B.2H2(g)+ O2(g) = 2H2O(1)△H= +571.6 kJ/mol |
| C.2H2(g)+O2(g) = 2H2O(g)△H= ―571.6 kJ/mol |
D.H2(g)+ 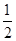 O2(g) = H2O(1)△H= ―285.8kJ/mol O2(g) = H2O(1)△H= ―285.8kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com