
| A. | 探究温度对反应速率影响时,分别水浴加热硫代硫酸钠溶液、硫酸溶液到一定温度,再将两溶液混合 | |
| B. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 | |
| C. | 用简易量热计测定反应热,使用碎泡沫隔热保温、环形玻璃搅拌棒搅拌、量取达到的最高温度,计算反应热,取2~3 次的实验平均值 | |
| D. | 取皂化反应后的混合液滴入热水中,观察现象,可判断皂化反应是否完全 |
分析 A.控制其他量相同,只控制温度不同;
B.酶的催化活性会受到温度的影响;
C.用简易量热计测定反应热注意保温;
D.油脂不溶于水.
解答 解:A.探究温度对反应速率的影响时,控制其他量相同,只控制温度不同,则应将混合物分别在热水、冷水中反应,故A正确;
B.过氧化氢酶的催化活性会受到温度的影响,温度过高,蛋白质变性,失去催化效力,故B错误;
C.用简易量热计测定反应热,使用碎泡沫隔热保温、环形玻璃搅拌棒搅拌、量取达到的最高温度,可起到保温作用,计算反应热,取2~3 次的实验平均值,可减小实验误差,故C正确;
D.高级脂肪酸钠可溶于水,若有不溶物说明反应不完全,故D正确;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及皂化反应、催化剂对反应速率影响、探究实验等知识点,明确物质性质及实验原理是解本题关键,易错选项是B,注意催化剂受温度影响.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
| 时间 (s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol/L | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
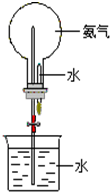 已知氨气与氯化氢气体都是极易溶于水的气体,在标准状况下1升水中最多能溶解500升的氯化氢气体,或者700升的氨气.
已知氨气与氯化氢气体都是极易溶于水的气体,在标准状况下1升水中最多能溶解500升的氯化氢气体,或者700升的氨气.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:NH4+、Fe2+、SO42-、Cl- | |
| B. | 通入CO2气体的溶液中:Ca2+、I-、ClO-、NO3-、 | |
| C. | c(Fe3+)=0.1 mol•L-1的溶液中:Na+、I-、SCN-、SO42- | |
| D. | 由水电离出的c(H+)=1.0×10-13 mol•L-1的溶液中:Na+、HCO3-、Cl-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
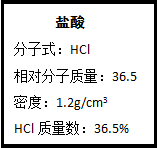 图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 我校环保兴趣小组在处理污水样品时,需用质量分数为36.5%的浓盐酸、密度为1.19g/cm3)配制成250mL 0.1mol•L-1的盐酸溶液.
我校环保兴趣小组在处理污水样品时,需用质量分数为36.5%的浓盐酸、密度为1.19g/cm3)配制成250mL 0.1mol•L-1的盐酸溶液.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com