
【题目】下列各项中的离子方程式,书写正确的是 ( )
A.AlCl3水解:Al3++3H2O=Al(OH)3+3H+
B.NaHCO3电离:NaHCO3![]() Na++HCO3-
Na++HCO3-
C.固体Ca(OH)2与NH4Cl共热:NH4++OH-=NH3+H2O
D.过量的CO2气体通入饱和石灰水中:CO2+OH-=HCO3-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠。
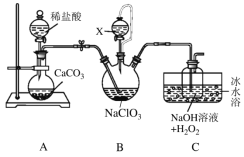
已知:①ClO2沸点为9.9℃,可溶于水,有毒,浓度较高时易发生爆炸。
②NaClO2饱和溶液低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解为NaClO3和NaCl。
③B装置为ClO2发生装置,所用试剂NaClO3、H2SO4(浓)、CH3OH。
请回答下列问题:
(1)装置B中试剂X的名称为___________;盛放该试剂的仪器的名称为________________。
(2)实验过程中需持续通入一定量的CO2,其目的是______________;反应结束后需再通入一定量的CO2,其目的是_____________________。
(3)装置C中的水浴温度应控制在____________________(填温度范围);装置C中生成NaClO2的离子方程式为___________________。
(4)上述装置存在一处明显的缺陷,其改进措施为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
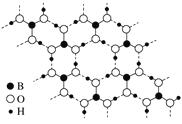
【题目】Calanolide A是一种抗HIV药物,其结构简式如图所示。下列关于Calanolide A的说法错误的是( )

A. 分子中有3个手性碳原子
B. 分子中有3种含氧官能团
C. 该物质既可发生消去反应又可发生加成反应
D. 1mol该物质与足量NaOH溶液反应时消耗1molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是
A.NaHSO4在熔融状态下的电离方程式:NaHSO4=Na++HSO4-
B.H2SO4溶液与NaOH溶液发生中和反应的热化学方程式为(已知H2SO4 溶液与NaOH溶液发生反应的中和热为57.3 kJ/mol):H2SO4(aq)+2NaOH(aq)=2H2O(l)+Na2SO4(aq) △H=-57.3kJ/mol
C.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.CaCO3的沉淀溶解平衡方程式:CaCO3(s)=Ca2+(aq)+CO32-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
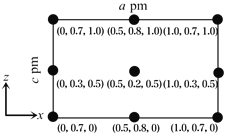
【题目】非线性光学晶体在信息、激光技术、医疗、国防等领域具有重要应用价值。我国科学家利用Cs2CO3、XO2(X=Si、Ge)和H3BO3首次合成了组成为CsXB3O7的非线性光学晶体。回答下列问题:
(1)C、O、Si三种元素电负性由大到小的顺序为__________;第一电离能I1(Si) ____ I1(Ge)(填“>”或“<”)。
(2)基态Ge原子核外电子排布式为_____________;SiO2、GeO2具有类似的晶体结构,其中熔点较高的是________,原因是______。
(3)如图为H3BO3晶体的片层结构,其中B的杂化方式为________;硼酸在热水中比在冷水中溶解度显著增大的主要原因是_____________。
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。CsSiB3O7属于正交晶系(长方体形),晶胞参数为a pm,b pm和c pm。如图为沿y轴投影的晶胞中所有Cs原子的分布图和原子分数坐标。据此推断该晶胞中Cs原子的数目为_______;CsSiB3O7的摩尔质量为M g·mol-1,设NA为阿伏加德罗常数的值,则CsSiB3O7晶体的密度为_____________g·cm-1(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项正确的是
A. 25℃时,AgBr在0.01mol/L的MgBr2溶液和NaBr溶液中的溶解度相同
B. NaCN溶液和盐酸混合呈中性的溶液中:c(Na+)>c(Cl-)=c(HCN)
C. 25℃时,将0.01mol/L的醋酸溶液加水不断稀释,  减小
减小
D. Na2CO3、NaHCO3溶液等浓度等体积混合后: 3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列五种溶液:
①0.1 mol/L NH4Cl ②0.1 mol/L CH3COONH4 ③0.1 mol/L NH4HSO4 ④0.1 mol/L NH3·H2O和0.1 mol/L NH4Cl混合液 ⑤0.1 mol/L NH3·H2O,请根据要求填写下列空白:
(1)溶液①呈______性(填“酸”“碱”或“中”),其原因是_____________(用离子方程式表示)
(2)在溶液④中______离子的浓度为0.1mol/L;NH3·H2O和_____离子的量浓度之和为0.2mol/L。
(3)室温下,测得溶液②的pH=7,则说明CH3COO-的水解程度_______(填“>”“<”或“=”)NH4+的水解程度,CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)______c(NH4+)
(4)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。
①写出酸H2A的电离方程式________。
②若溶液M由10mL 2mol·L-1NaHA溶液与2mol·L-1NaOH溶液等体积混合而得,则溶液M的pH________7(填“>”、“<”或“=”)。
(5)已知:在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液。回答下列问题:
①两溶液中,c(H+)·c(OH-)=__________。
②各取5mL上述溶液,分别加水稀释至50mL,pH较大的是________溶液。
③各取5mL上述溶液,分别加热到90℃,pH较小的是__________溶液。
④H2SO4和NH4Cl两溶液中,由水电离出的c(H+)分别为__________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是以石油为原料的部分转化流程:
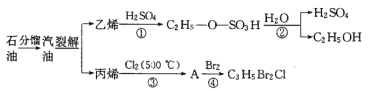
已知:C2H5Br+NaOH![]() C2H5OH+NaBr(水解反应)
C2H5OH+NaBr(水解反应)
(1)反应①的类型是_________,由乙烯制备乙醇的过程中,硫酸起________作用;
(2)已知A的分子式为C3H5Cl,则A的结构简式为___________;
(3)C3H5Br2Cl与NaOH水溶液完全反应生成有机产物X,则1molX与足量的Na单质反应可生成标况下_________L氢气;
(4)写出丙烯通入溴的CCl4溶液中发生反应的化学方程式:______________________。
(5)相对分子质量为72且沸点最低的烷烃的结构简式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定法是一种重要的定量分析方法,应用范围很广。
(1)下图是用0.100 0 mol·L-1的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。
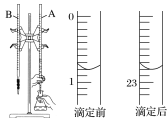
请回答下列问题:
①仪器A的名称是____________。
②盐酸的体积读数:滴定后读数为________mL。
(2)玉溪市场上销售的“白象牌”食用精制盐包装袋上有如下部分说明:
产品等级 | 一级 |
配料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50 mg·kg-1 |
某学生拟测定食用精制盐的碘(KIO3)含量,其步骤:
a.准确称取W g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.加入指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全(I2+2S2O32-===2I-+S4O62-)。
①c中指示剂是_______________,判断c中恰好完全反应所依据的现象是___________。
②写出步骤b的离子方程式_____________________。
③b中反应所产生的I2的物质的量是________ mol。
④根据以上实验和包装袋说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)_______mg·kg-1。
⑤若滴定前滴定管尖嘴处有气泡,滴定后消失,则测定结果________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com