
| A. | O、S、Na、K的原子半径一次增大 | |
| B. | Na、Mg、Al、Si的金属性逐渐增强 | |
| C. | HF、HCl、HBr、HI的沸点依次增高 | |
| D. | KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强 |
分析 A、根据同一周期,从左至右,元素原子的半径逐渐减小以及同一主族,从上到下,元素原子的半径逐渐增大;
B、根据同一周期,从左至右,元素的金属性逐渐减弱;
C、根据分子晶体的沸点随着相对分子质量的增大而增大,但要注意:如果分子间能形成氢键就使其沸点增大;
D、据元素的金属性越强其对应的最高价氧化物对应的水化物的碱性越强.
解答 解:A、因同一主族,从上到下,元素原子的半径逐渐增大,所以半径:S>O,K>Na,又因同一周期,从左至右,元素原子的半径逐渐减小,所以半径:Na>S,则半径:K>Na>S>O,故A正确;
B、因同一周期,从左至右,元素的金属性逐渐减弱,则金属性:Na>Mg>Al>Si,故B错误;
C、分子晶体的沸点随着相对分子质量的增大而增大,但要注意:如果分子间能形成氢键就使其沸点增大,HF中能形成分子间氢键,导致其沸点增大,HI、HBr、HCl、HF的沸点不是依次降低,故C错误;
D、因元素的金属性越强其对应的最高价氧化物对应的水化物的碱性越强,金属性:K>Ca>Mg>Al,所以碱性:KOH>Ca(OH)2>Mg(OH)2>Al(OH)3,故D错误;
故选A.
点评 本题考查元素周期律,比较基础,侧重对基础知识的巩固,注意对元素周期律的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | X:3s23p1 Y:3s23p5 | B. | X:2s22p3 Y:2s22p4 | ||
| C. | X:3s23p1 Y:2s22p4 | D. | X:3s2 Y:2s22p3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 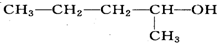 的名称是1-甲基-1-丁醇 的名称是1-甲基-1-丁醇 | |
| B. | 食醋中含有乙酸,乙酸可由乙醇或乙醛氧化得到 | |
| C. | 1mol 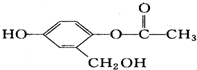 最多能与4molNaOH溶液反应 最多能与4molNaOH溶液反应 | |
| D. | 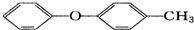 的同分异构体中有醇、酚、脂等类别 的同分异构体中有醇、酚、脂等类别 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中的所有碳原子不在同一条直线上 | |
| B. | 在光照条件下,可与Cl2发生取代反应 | |
| C. | 丙烷的沸点比丁烷的沸点高,更易液化 | |
| D. | 丙烷难溶于水,且密度小于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L的甲酸溶液中c(H+)约为0.01mol/L | |
| B. | 甲酸与水以任意比例互溶 | |
| C. | 10mL 1mol/L的甲酸溶液恰好与10mL 1mol/L的NaOH溶液完全反应 | |
| D. | 在相同温度下,物质的量浓度相同的甲酸导电性比硫酸弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
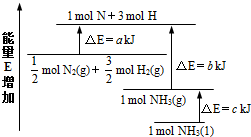 氨气是氮循环中的重要物质,在人类的生产生活中有着广泛的应用.
氨气是氮循环中的重要物质,在人类的生产生活中有着广泛的应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com