
【题目】下列叙述正确的是( )
A. △H>0的化学反应一定不能自发进行
B. 反应2NO2(g)![]() N2O4(l)的熵(体系的混乱度)增大(即△S>0)
N2O4(l)的熵(体系的混乱度)增大(即△S>0)
C. FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
D. Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
科目:高中化学 来源: 题型:
【题目】20℃时H2S饱和液浓度为0.1 mol·L-1,电离方程式为H2S ![]() H++HS-,HS-
H++HS-,HS-![]() H++S2-,若要使该溶液H+浓度增大,同时使S2-浓度减小,可采取的措施是
H++S2-,若要使该溶液H+浓度增大,同时使S2-浓度减小,可采取的措施是
A. 加入少量的水 B. 加入少量的NaOH固体
C. 通入少量的SO2 D. 加入少量的CuSO4固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三蝶烯是最初的“分子马达”的关键组件,三碟烯某衍生物X可用于制备吸附材料,其结构如图所示,3个苯环在空间上互为120°夹角。下列有关X的说法错误的是

A. 分子式为C22H14O4
B. 能发生加成、取代反应
C. 苯环上的一氯代物有3种
D. 分子中最多可能有20个原子位于同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下图所示装置,装置A是氢氧燃料电池,已知该装置工作时电子从b极流向Fe电极。
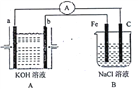
(1)C电极反应式为___________________________。
(2)若装置B中溶液体积为100mL,假设反应前后溶液体积不变,当装置A中消耗0.05mol氢气时,装置B中溶液的pH为_____,此时要恢复原溶液的浓度需加入______(填化学式)。
(3)若将装置B改为电解精炼铜,则粗铜作____极,阴极反应为_________。
II.用零价铁(Fe)去除水体中的的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中(NO3-)的反应原理如图所示。

①作负极的物质是_______________。②正极的电极反应式是_________________________。
(2)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在___极,该电极反应式是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上最大的钨储藏国。金属钨可用于制造灯丝、超硬模具和光学仪器。在工业上常采用高温还原WO3法制取金属钨。回答下列问题:
(1)白钨矿(主要成分是CaWO4)与盐酸反应生成沉淀,灼烧沉淀即可得到WO3,上述两步反应的化学方程式为_________________、__________________。
(2)T℃时,WO3经如下的四步反应生成W。每一步反应的焓变和平衡常数如下: WO3(s)+0.1H2(g)![]() WO2.9(s)+0.1H2O(g) △H1 K1
WO2.9(s)+0.1H2O(g) △H1 K1
WO2.9(s)+0.18H2(g)![]() WO2.72(s)+0.18H2O(g) △H2 K2
WO2.72(s)+0.18H2O(g) △H2 K2
WO2.72(s)+0.72H2(g)![]() WO2(s)+0.72H2O(g) △H3 K3
WO2(s)+0.72H2O(g) △H3 K3
WO2(s)+2H2(g)![]() W(s)+2H2O(g) △H4 K4
W(s)+2H2O(g) △H4 K4
则该温度下,WO3(s)+3H2(g)![]() W(s)+3H2O(g) △H=_________,K=__________。
W(s)+3H2O(g) △H=_________,K=__________。
(3)T1℃时,将一定质量WO3和8.0gH2置于2L密闭容器中,发生反应: WO3(s)+3H2(g)![]() W(s)+3H2O(g),混合气体各组分物质的量之比随时间变化的关系如图所示:
W(s)+3H2O(g),混合气体各组分物质的量之比随时间变化的关系如图所示:

①T1℃时,H2的平衡转化率a=_________%,反应平衡常数K=__________。
②若在4min时降低并维持温度为T2℃,则该反应的△H_______0,若在8min时缩小容器容积,则![]() _________1.3。(填“>”“ <”或“=”)
_________1.3。(填“>”“ <”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应和离子反应是高一所学过的重要化学反应类型,仔细思考回答下列问题:
(Ⅰ)下列一组有水参与的反应:
①2Na + 2H2O = 2NaOH + H2↑ ②2Na2O2 + 2H2O = 4NaOH + O2↑
③Na2O + H2O =2NaOH ④2H2O![]() 2H2↑+ O2↑ ⑤2F2 + 2H2O = 4HF + O2
2H2↑+ O2↑ ⑤2F2 + 2H2O = 4HF + O2
(1)其中不属于氧化还原反应的是____________(填编号)
(2)在这些氧化还原反应中,水只作氧化剂的反应是___________(填编号);水只作还原
剂的反应是___________(填编号);水既作氧化剂,又作还原剂是_________(填编号);水既不作氧化剂,又不作还原剂是___________(填编号)。
(3)根据你的理解,氧化还原反应的特征是_____。
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
(4)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?______(填“是”或“不是”),若是,这个反应的氧化剂是_________,氧化产物是________,被氧化的氮元素与被还原的氮元素的物质的量之比是______;如果3mol的NO2完全反应,应转移____________个电子。
(Ⅱ)现有以下物质:(填序号)
① 铜 ② CO2 ③ 水 ④ CaCO3固体 ⑤ 蔗糖
以上物质中能导电的是______________,以上物质中属于电解质的是____________,以上物质中属于非电解质的________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是( )
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是( )
A. 2v(NH3)=v(CO2) B. 密闭容器中c(NH3)∶c(CO2)=2∶1
C. 密闭容器中混合气体的密度不变 D. 密闭容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH==5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A. Cl2是氧化剂,NaOH是还原剂
B. 被氧化的Cl原子和被还原的Cl原子的物质的量之比为5∶1
C. Cl2既做氧化剂又做还原剂
D. 氧化剂得电子数与还原剂失电子数之比为5∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时,Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7;p(Ni)=-lgc(Ni2+),p(B)=lgc(S2-)或-lgc(CO32-)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀(温度升高,NiS、NiCO3Ksp均增大),298K时,溶液中阳离子、阴离子浓度的负对数关系如图所示。下列说法不正确的是

A. 常温下NiCO3的溶解度大于NiS的溶解度
B. 向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动
C. 对于曲线I,在b点加热(忽略蒸发),b点向c点移动
D. M为3.5且对应的阴离子是CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com