
| 温度/℃ | 500 | 525 | 550 | 575 | 600 |
| 平衡转化率/% | 93.5 | 90.5 | 85.6 | 80.0 | 73.7 |
分析 (1)S的原子结构为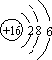 ,电子层数等于周期数,最外层电子数等于族序数;
,电子层数等于周期数,最外层电子数等于族序数;
(2)硒(34Se)与硫在元素周期表中位于同一主族,性质相似,非金属性S>Se;
(3)①2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H1=-545kJ/mol
②H2O(g)=H2O(l)△H2=-44kJ/mol
③SO3(g)+H2O(l)=H2SO4(l)△H3=-130kJ/mol
由盖斯定律可知,①-②×2-③×2得到2SO2(g)+O2(g)?2SO3(g),以此计算△H;
(4)由数据可知,温度越高,转化率越低;575℃达平衡时,SO2平衡转化率为80%,则
2SO2(g)+O2(g)?2SO3(g)
开始 7 11
转化 5.6 2.8 5.6
平衡 1.4 8.2 5.6
总体积为100-5.6-2.8+5.6=97.2L;
(5)氯气具有强氧化性,SO32-中+4价的硫具有还原性,氯气与SO32-会发生氧化还原反应;溶液显碱性时能与溴水反应,不能确定溴水与SO32-会发生氧化还原反应.
解答 解:(1)S的原子结构为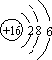 ,则S位于第三周期ⅥA族,故答案为:第三周期ⅥA族;
,则S位于第三周期ⅥA族,故答案为:第三周期ⅥA族;
(2)a.水中含氢键,沸点最高,则沸点:H2O>H2Se>H2S,故a错误;
b.非金属性S>Se,则H2Se比H2S稳定性弱,故b错误;
c.同主族,原子序数大的原子半径大,则Se的原子半径比S原子大,故c正确;
d.SeO2和SO2含有共价键,化学键类型相同,故d正确;
故答案为:c d;
(3)(3)①2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H1=-545kJ/mol
②H2O(g)=H2O(l)△H2=-44kJ/mol
③SO3(g)+H2O(l)=H2SO4(l)△H3=-130kJ/mol
由盖斯定律可知,①-②×2-③×2得到2SO2(g)+O2(g)?2SO3(g),则△H=(-545kJ/mol)-(-44kJ/mol)×2-(-130kJ/mol)×2=-197kJ/mol,
故答案为:-197;
(4)由数据可知,温度越高,转化率越低,则该反应为放热反应,升高温度,平衡逆向移动,总体积变大,则达平衡态时N2的体积分数随着温度升高而减小;
575℃达平衡时,SO2平衡转化率为80%,则
2SO2(g)+O2(g)?2SO3(g)
开始 7 11
转化 5.6 2.8 5.6
平衡 1.4 8.2 5.6
总体积为100-5.6-2.8+5.6=97.2L;
SO3的体积分数为$\frac{5.6}{97.2}$×100%=5.8%,
故答案为:减小; 5.8;
(5)①吸收SO2后的碱性溶液还可用于Cl2的尾气处理,亚硫酸钠与氯气发生氧化还原反应生成硫酸钠和盐酸,则吸收Cl2后的溶液中一定存在的阴离子有OH-、SO42-、Cl-,故答案为:SO42-、Cl-;
②滴加黄色的溴水,得到无色溶液.此实验不能证明溶液中含有SO32-,理由是NaOH溶液能跟溴单质反应,使溶液呈无色,故答案为:NaOH溶液能跟溴单质反应,使溶液呈无色.
点评 本题考查较综合,涉及化学平衡计算、盖斯定律计算、氧化还原反应及同族元素的性质等,综合性较强,侧重分析与应用能力及化学反应原理的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 是银白色质软的金属 | B. | 能形成+3价的化合物 | ||
| C. | Tl(OH)3一定是两性氢氧化物 | D. | 单质铊的还原性一定比单质铝强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
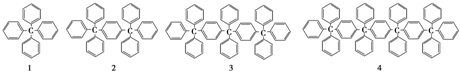
| A. | C198H146 | B. | C196H155 | C. | C196H146 | D. | C198H155 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖、麦芽糖均能与银氨溶液反应 | |
| B. | 甘氨酸和丙氨酸缩合最多可以形成四种二肽 | |
| C. | 富含蛋白质的豆浆煮沸后即可得人体所需的氨基酸 | |
| D. | 油酯在氢氧化钾溶液中水解可制得汽车洗涤用的液体肥皂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
铝制饭盒 | 聚乙烯盒 | 铁罐车 | 带玻璃塞的试剂瓶 |
| 不宜长时间存放 酸性或碱性的食物 | 能用于盛放食品 | 可用于运输浓硫酸 | 可用于盛放 氢氧化钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S和KNO3都是反应的氧化剂 | B. | C在反应中得电子 | ||
| C. | CO2是反应的氧化产物 | D. | K2S和N2都是反应的还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该化合物含有离子键和共价键 | |
| B. | 1molO2参与该反应时,得到1mol电子 | |
| C. | 该化合物中阳离子与阴离子个数比为2:1 | |
| D. | O2PtF6的熔点可能比O2低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强酸和强碱的中和反应的活化能接近于零,所以反应速率很高 | |
| B. | 过程的自发性既能用于判断过程的方向,也能用于判断过程发生的速率 | |
| C. | 电解质溶液导电的过程中,一定发生了电解质溶液的电解 | |
| D. | 溶解度较小的BaSO4在一定条件下也可以转化为溶解度略大的BaCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com