
【题目】有A、B、C、D四种元素,其中A和B原子都有1个未成对电子,A+比B﹣少一个电子层.B原子得一个电子填入3p轨道后,3p轨道已充满.C原子的p轨道中有3个未成对电子,其气态氢化物的水溶液的pH在同族氢化物中最大.D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D 40%,且其核内质子数等于中子数.据此判断:
(1)A是 , B是 , C是 , D是 . (填元素符号)
(2)B﹣的电子排布式 , A+的结构示意图 .
(3)在A、B、D三种元素的简单离子中,半径最小的是 , 其离子还原性最强的是 . (填离子符号)
【答案】
(1)Na;Cl;N;S
(2)1s22s22p63s23p6;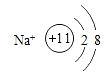
(3)Na+;S2﹣
【解析】解:B原子得一个电子填入3p轨道后,3p轨道已充满,B为Cl元素;A+比B﹣少一个电子层,则A为Na;C原子的p轨道中有3个未成对电子,C原子的外围电子排布为ns2np3 , 是第ⅤA族元素,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大,所以为N元素;D的最高化合价和最低化合价的代数和为4,为第ⅥA族元素,最高价氧化物中含D的质量分数为40%,可推知D的相对原子质量为32,其核内质子数等于中子数,所以质子数为16,D为S元素;A+是Na+离子,D2﹣离子是S2﹣离子,(1)A是 Na,B是Cl,C是N,D是S,所以答案是:Na;Cl;N;S;(2)Cl﹣的电子排布式1s22s22p63s23p6 , 钠离子的结构示意图为: 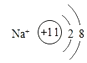 ,所以答案是:1s22s22p63s23p6;
,所以答案是:1s22s22p63s23p6;  ;(3)在Na、Cl、S三种元素的简单离子中,电子层数越小半径越小,所以半径最小的是Na+ , 其离子还原性最强的是S2﹣ , 所以答案是:Na+;S2﹣ .
;(3)在Na、Cl、S三种元素的简单离子中,电子层数越小半径越小,所以半径最小的是Na+ , 其离子还原性最强的是S2﹣ , 所以答案是:Na+;S2﹣ .


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知:①RNH2+R′CH2Cl ![]() RNHCH2R′+HCl(R和R′代表烃基) ②苯的同系物能被高锰酸钾氧化,如:
RNHCH2R′+HCl(R和R′代表烃基) ②苯的同系物能被高锰酸钾氧化,如: ![]()
![]()
![]()
③ ![]()
![]()
![]() (苯胺,弱碱性,易被氧化)化合物C是制取消炎灵(祛炎痛)的中间产物,其合成路线如图所示:
(苯胺,弱碱性,易被氧化)化合物C是制取消炎灵(祛炎痛)的中间产物,其合成路线如图所示: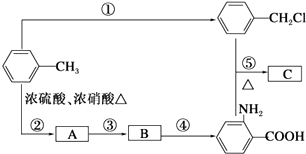
请回答下列问题:
(1)B物质的结构简式是 .
(2)写出反应①、②的化学方程式: ①;
② .
(3)反应①~⑤中,属于取代反应的是(填反应序号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.Zn和浓硫酸反应 Zn+2H+═H2↑+Zn2+
B.钠与水反应:Na+2H2O═Na++2OH﹣+H2↑
C.硫酸铝溶液与过量氢氧化钠溶液反应:Al3++4OH﹣═AlO ![]() +2H2O
+2H2O
D.向Ca(ClO)2溶液中通入少量CO2:ClO﹣+H2O+CO2═HClO+HCO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置,写出除去下列物质中的杂质的方法,并写出化学方程式(括号内的气体为杂质). 
(1)CO2( SO2) , 化学方程式 .
(2)SO2 ( HCl ) , 化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是环保部门监测有害气体常用的一种药品,它易溶于水,遇酸易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图。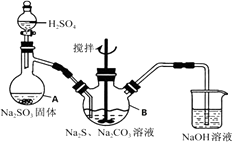
实验具体操作步骤为:
①打开分液漏斗使硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体较均匀的通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。
(1)写出仪器A的名称。
(2)写出A中发生反应的化学方程式。
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是。
(4)Na2S2O3常用作脱氯剂,在溶液中易被Cl2氧化成SO42离子,该反应的离子方程式为。
(5)为了验证固体硫代硫酸钠工业产品中含有碳酸钠,选用下图装置进行实验。
①实验装置的连接顺序依次是(填装置的字母代号),装置C中的试剂为。
②能证明固体中含有碳酸钠的实验现象是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:3CH4(g)+2N2(g)3C(s)+4NH3(g)△H>0,700℃时,CH4与N2在不同物质的量之比[ ![]() ]时CH4的平衡转化率如图所示.下列说法正确的是( )
]时CH4的平衡转化率如图所示.下列说法正确的是( ) 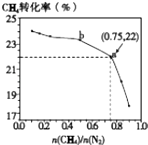
A.![]() 越大,CH4的转化率越高
越大,CH4的转化率越高
B.![]() 不变时,若升温,NH3的体积分数会增大
不变时,若升温,NH3的体积分数会增大
C.b点对应的平衡常数比a点的大
D.a点对应的NH3的体积分数约为26%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(18分)用沉淀滴定法快速测定NaI等碘化物溶液中c(I),实验过程包括准备标准溶液和滴定待测溶液。 Ⅰ.准备标准溶液
a.准确称取AgNO3基准物4.2468 g(0.0250 mol)后,配制成250 mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100 mL 0.1000 mol·L1 NH4SCN标准溶液,备用。
Ⅱ.滴定的主要步骤
a.取待测NaI溶液25.00 mL于锥形瓶中。
b.加入25.00 mL 0.1000 mol·L1 AgNO3溶液(过量),使I完全转化为AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示剂。
d.用0.1000 mol·L1NH4SCN溶液滴定过量的Ag+ , 使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。
e.重复上述操作两次。三次测定数据如下表:
实验序号 | 1 | 2 | 3 |
消耗NH4SCN标准溶液体积/mL | 10.24 | 10.02 | 9.98 |
f.数据处理。
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有。
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是。
(3)滴定应在pH<0.5的条件下进行,其原因是。
(4)b和c两步操作是否可以颠倒 , 说明理由。
(5)所消耗的NH4SCN标准溶液平均体积为mL,测得c(I-)=mol·L-1。
(6)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为。
(7)判断下列操作对c(I-)测定结果的影响(填“偏高”、“偏低”或“无影响”) ①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com