
【题目】反应 2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 可用于工业上制备 Na2S2O3。下列化学用语表示正确的是
A.中子数为20的硫原子:![]() S
S
B.Na+的结构示意图: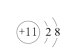
C.Na2S的电子式:![]()
D.CO32-水解的离子方程式 CO32-+2H2O=H2CO3+2OH-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )
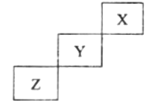
A.非金属性强弱: Z> Y
B.气态氢化物的稳定性: Y>Z
C.最高价氧化物的水化物酸性: Y>Z
D.常压下X的单质化学性质非常活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,并回答下列问题:
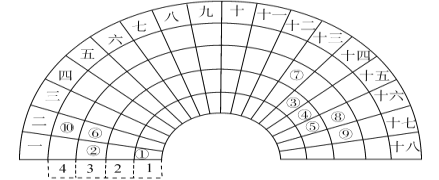
(1)若①~⑩分别代表十种元素,则⑩代表的元素处于常见周期表的位置是_______________________;
(2)⑥⑦为生活中两种常见的金属,其最高价氧化物对应水化物的碱性:⑥____⑦(填>、<或=);比较元素⑧⑨对应的常见单质氧化性的强弱,并用化学方程式证明:____________________________________;
(3)①③⑤三种元素形成的18电子结构化合物是近年来燃料电池研究领域的新宠,写出用它作燃料,②最高价氧化物对应的水化物作为电解质的燃料电池的负极反应式:___________________________;
(4)用电子式表示④的一种10电子结构氢化物的形成过程:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 电池可用于驱动无人潜航器。该电池以海水为电解质溶液,如图所示。该电池工作时,下列说法正确的是 ( )
电池可用于驱动无人潜航器。该电池以海水为电解质溶液,如图所示。该电池工作时,下列说法正确的是 ( )
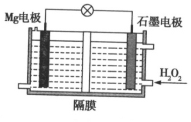
A.电池总反应是![]()
![]()
![]()
B.![]() 在石墨电极上反应放出氧气
在石墨电极上反应放出氧气
C.石墨电极附近溶液的pH增大
D.溶液中![]() 向正极移动
向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)上海白龙港污水处理厂升级改造,处理废水时加入明矾可作为混凝剂以吸附水中的杂质,利用漂白粉可用来杀菌消毒,工业上利用氯气和石灰乳制取漂白粉的化学反应方程式是___________,其中___________是漂白粉的有效成分;
(2)生产硅酸盐水泥和普通玻璃都需要用到的主要原料是__________(填名称);
(3)在雷电作用下,大气中游离态的氮会少量转化为化合态的氮并随雨水落下,这是自然中固定氮的途径之一。用化学方程式表示上述过程。________,_______,______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液的pH通常在7.35-7.45之间的原因是血液中存在NaH2PO4-Na2HPO4等缓冲体系。常温下:Ka1(H3PO4)=7.6×10-3、Ka2(H3PO4)=6.3×10-8。下列指定溶液中微粒物质的量浓度关系正确的是
A.0.1mol/L NaH2PO4溶液:2c(HPO42-)+3c(PO43-)>c(Na+)-c(H2PO4-)
B.常温下,pH=7的NaH2PO4和Na2HPO4的混合溶液:c(Na+)>c(HPO42-)>c(H2PO4-)
C.向10 mL0.1mol/L NaH2PO4溶液中加入5mL 0.4 mol/L NaOH溶液:c(H+)+3c(H3PO4)+2c(H2PO4-)+c(HPO42-)=c(OH-)
D.物质的量浓度相等NaH2PO4和Na2HPO4溶液等体积混合:3[c(H2PO4-)+c(HPO42-)+c(PO43-)]=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以含银废液{主要含[Ag(NH3)2]+、[Ag(S2O3)2]3-}为原料制取硝酸银晶体,其实验流程如下:

已知:①“沉银”所得AgCl中含有少量PbCl2、Ag2S。
②Zn2+在浓氨水中以[Zn(NH3)4]2+形式存在。
③PbCl2、AgNO3的溶解度曲线如图所示:

(1)“滤液”中的主要阳离子为___(填化学式)。
(2)“除杂”分为两步:先除去PbCl2,再除去Ag2S。
①在不同温度下,AgCl、Ag2S均难溶于水。 除去PbCl2的操作为______,热水洗涤。
②向热水洗涤所得固体中加入浓硝酸和稀盐酸,边加热边充分搅拌,使Ag2S转变为AgCl。加入浓硝酸的目的是_______。
(3)室温下,可逆反应AgCl+2NH3·H2O[Ag(NH3)2]++Cl-+2H2O的平衡常数K=___。{Ksp(AgCl)= 1.8×10-10,Ag++2NH3·H2O[Ag(NH3)2]++2H2O的平衡常数为1.1×107}
(4)“还原”过程中发生反应的离子方程式为_____ 。
(5)粗银经水洗后,经多步处理可制备硝酸银晶体。请补充完整由以水洗后粗银为原料,制备硝酸银晶体的实验方案:________,过滤,________,将产生的气体和空气混合后通入NaOH溶液进行尾气处理,将所得AgNO3溶液_______,过滤,将所得晶体置于烘箱 (120℃)干燥,密封包装。(实验中须使用的试剂:稀硫酸、稀硝酸、BaC12溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是:600℃ 时,在2L密闭容器里A、B、C三种气体在密闭容器中反应时浓度的变化,其中A为有色气体,B、C是无色气体。请从图中分析并填空:
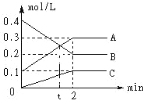
(1)该反应的化学反应方程式为_____
(2)反应达到平衡状态时,反应物的转化率为_____
(3)当反应进行到第_____min,该反应达到平衡。
(4)反应从开始至2分钟末,B的物质的量_____,用B的浓度变化表示的平均反应速率为v(B)=_
(5)下列描述能表示反应达平衡状态的是_____(填选项)。
a.容器中A与B的物质的量相等
b.容器内气体的颜色不再改变
c.各物质的浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气及硝酸工业废气中氮氧化物的处理是治理环境污染的重要课题。
(1)汽车尾气中的NO(g)和CO(g)在一定条件下可发生如下反应:
反应I:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H1
N2(g)+2CO2(g)△H1
反应II:N2(g)+O2(g)![]() 2NO(g)△H2=+180.5kJ·mol-1
2NO(g)△H2=+180.5kJ·mol-1
已知CO的燃烧热为283.0kJ·mol-1,则△H1=________________。
(2)某研究小组探究催化剂对上述反应I的影响。将NO和CO混合气体以定的流速分别通过两种不同的催化剂a和b进行反应,在相同时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(脱氮率即NO的转化率),得到图1中a、b两条曲线。温度低于200℃时,图1中曲线a脱氮率随温度升高而变化不大的主要原因为________________;m点________________(填“是”或者“不是”)对应温度下的平衡脱氮率,说明理由________________。
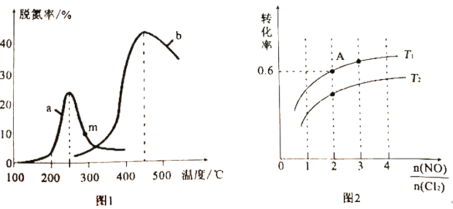
(3)一定条件下Cl2也可以与NO反应,生成一种有机合成中的重要试剂亚硝酰氯(NOCl),化学方程式为:2NO(g)+Cl2(g)![]() 2NOCl(g)△H<0。在恒温恒容条件下,将物质的量之和为3mol的NO(g)和Cl2(g)以不同的氮氯比[
2NOCl(g)△H<0。在恒温恒容条件下,将物质的量之和为3mol的NO(g)和Cl2(g)以不同的氮氯比[![]() ]通入容器中进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图2所示。
]通入容器中进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图2所示。
①图2中T1、T2的关系为T1________________T2(填“>”“<”或“=”)。
②图2中纵坐标为反应物________________的转化率,理由为________________。
③若在温度为T1,容积为1L恒容密闭的容器中反应,经过10min到达A点,则0~10min内反应速率v(NO)=________________mol·L-1·min-1。
④已知:用气体分压替代浓度计算的平衡常数叫压强平衡常数(Kp);分压=总压×气体物质的量分数。若该反应的起始压强为P0kPa,T1温度下该反应的压强平衡常数(Kp)为________________(用含P0的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com