下列叙述正确的是( )
A.2.4g金属镁变为镁离子时失去的电子数为0.1NA
B.1mo1/L盐酸中含1mo1HCl分子
C.在标准状况下,22.4LCH4与18gH2O所含有的分子数均为NA
D.22.4L的CO气体与lmolN2所含的电子数一定相等
【答案】
分析:A、先求出镁原子数目,由于一个镁原子失去2e
-变为镁离子,失去电子数是镁原子数目2倍;
B、选项中未给出溶液体积,无法确定溶质的物质的量,HCl是强电解质,在溶液中完全电离,不存在电解质分子;
C、计算出22.4LCH
4与18gH
2O的物质的量,物质的量相等则所含分子数相等;
D、气体摩尔体积v
m=22.4L/mol使用条件是标准状况(0°C,101kPa),每个CO与N
2分子都含有14个电子,物质的量相等则所含分子数相等.
解答:解:A、2.4g金属镁含有镁原子数目N(Mg)=
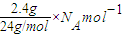
=0.1N
A,失去电子数为2×0.1N
A=0.2N
A,故A错误;
B、未给出溶液体积,无法确定溶质的物质的量,HCl是强电解质,在溶液中完全电离,不存在电解质分子,故B错误;
C、在标准状况下,22.4LCH
4的物质的量为n(CH
4)=
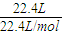
=1mol,含有CH
4的分子数为1mol×
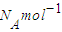
=N
A,
18gH
2O的物质的量为n(H
2O)=
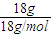
=1mol,含有H
2O的分子数为1mol×
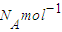
=N
A,故C正确;
D、不一定是标准状况下,气体摩尔体积v
m不一定是22.4L/mol,22.4L的CO气体的物质的量可能是1mol,也可能不是1mol,所含分子数可能相等也可能不相等,故D错误.
故选C.
点评:本题考查有关阿伏伽德罗常数的计算,注意气体摩尔体积v
m=22.4L/mol使用范围和条件,物质在溶液中的存在、电子转移.

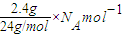 =0.1NA,失去电子数为2×0.1NA=0.2NA,故A错误;
=0.1NA,失去电子数为2×0.1NA=0.2NA,故A错误;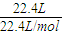 =1mol,含有CH4的分子数为1mol×
=1mol,含有CH4的分子数为1mol×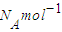 =NA,
=NA,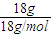 =1mol,含有H2O的分子数为1mol×
=1mol,含有H2O的分子数为1mol×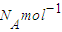 =NA,故C正确;
=NA,故C正确;
