
 奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图,下列有关奎尼酸的说法中正确的是( )
奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图,下列有关奎尼酸的说法中正确的是( )| A. | 奎尼酸的分子式是C7H9O6 | |
| B. | 1mol奎尼酸与足量NaOH溶液反应,最多消耗NaOH物质的量为5mol | |
| C. | 1 mol奎尼酸与足量钠反应生成56L氢气 | |
| D. | 奎尼酸能发生消去反应,也能与乙醇、乙酸发生取代反应 |
分析 由结构可知分子式,分子中含-COOH、-OH,结合羧酸、醇的性质来解答.
解答 解:A.奎尼酸的分子式是C7H12O6,故A错误;
B.只有-COOH与NaOH反应,则1mol奎尼酸与足量NaOH溶液反应,最多消耗NaOH物质的量为1mol,故B错误;
C.含-COOH、-OH,均与Na反应,则1 mol奎尼酸与足量钠反应生成2.5mol气体,但状况未知,不能计算其体积,故C错误;
D.含-OH,与乙酸发生取代反应,含-COOH与乙醇发生取代反应,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重羧酸、醇的性质及分析与应用能力的考查,题目难度不大.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,若要检验出其中的碳碳双键,方法是先加足量的银氨溶液使醛基氧化,然后再加入酸性的KMnO4溶液,若酸性KMnO4溶液的紫色褪去,证明有碳碳双键存在.
,若要检验出其中的碳碳双键,方法是先加足量的银氨溶液使醛基氧化,然后再加入酸性的KMnO4溶液,若酸性KMnO4溶液的紫色褪去,证明有碳碳双键存在.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
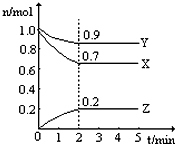 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲、乙、丙是常见的三种物质,它们之间有如图所示的转化关系.根据要求回答问题:
甲、乙、丙是常见的三种物质,它们之间有如图所示的转化关系.根据要求回答问题:| 温度/℃ | T1 | T2 |
| K | 2.041 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝溶液中加入过量氨水 Al3++30H-═Al(OH)3↓ | |
| B. | 向NH4HSO4溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全Ba2++H++OH-+SO42-═BaSO4↓+H2O | |
| C. | CuSO4溶液与少量的Ba(OH)2溶液:Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓ | |
| D. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 Fe2++2H++H2O2═Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NA个氢气分子所占的体积为22.4L | |
| B. | 2NA个二氧化碳分子的质量为44g | |
| C. | 1000mL0.1mol/L的NaCl溶液中,Na+和Cl-离子总数为0.2NA | |
| D. | 17g氨气中所含原子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤⑥ | B. | ①⑤⑦ | C. | ②④⑤⑥ | D. | ①④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 252 g•mol-1 | B. | 168 g•mol-1 | C. | 126 g•mol-1 | D. | 36 g•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com